
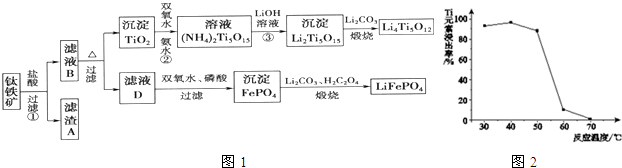
分析 铁矿石加入盐酸溶解过滤得到滤渣为二氧化硅,滤液B为MgCl2、CaCl2,FeCl2、TiOCl42-,加热促进水解,过滤得到彻底TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
(5)反应3是(NH4)2Ti5O15与氢氧化锂反应生成Li2Ti5O15沉淀和氨水;
(6)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
(7)充电时按照电解槽进行分析,阳极氧化阴极还原,写出阳极放电的电解方程式即可.
解答 解:(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是氧化还原反应,可以判断铁元素化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,
故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)根据流程图示可知,反应3是(NH4)2Ti5O15与氢氧化锂反应生成Li2Ti5O15沉淀和氨水,反应的化学方程式为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O),
故答案为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O);
(6)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y 34y=90×x×17%,x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:$\frac{20}{9}$;
(7)充电时,阳极发生氧化反应,LiFePO4失去电子生成FePO4,电极反应为:LiFePO4-e-=FePO4+Li+,
故答案为:LiFePO4-e-=FePO4+Li+.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,为高频考点和高考常见题型,考查了离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用废弃动植物油脂与低碳醇通过酯交换反应制成生物柴油来代替柴油作为机车燃料,这种做法符合“绿色化学”理念 | |
| B. | 生物炼铜是利用生物质能转化为化学能的原理实现的 | |
| C. | 元素分析仪不但可以检测物质中的许多非金属元素,也可以检测金属元素 | |
| D. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
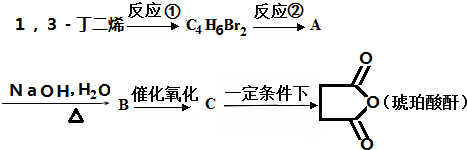
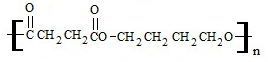 +2nH2O.
+2nH2O. 的合成路线.(无机试剂可以任选)
的合成路线.(无机试剂可以任选)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
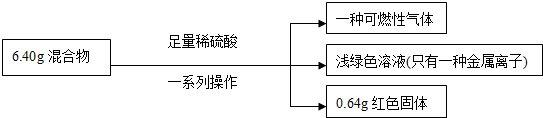
| A. | 原混合物中铜元素的质量不一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com