
科目:高中化学 来源: 题型:
现有常温条件下甲、乙、丙三种溶液,甲为
0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH= ;
(2)丙溶液中存在的电离平衡为
(用电离方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 ;
(4)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
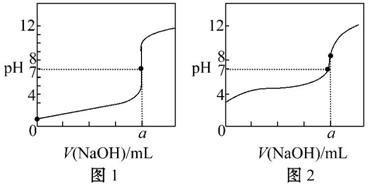
①甲溶液滴定丙溶液的曲线是 (填“图1”或“图2”);
②a= mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是( )
| 选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | 2Al+2OH-+2H2O==== 2 |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-==== Fe(OH)3↓ |
| C | 往NaHCO3溶液中滴入Ca(OH)2溶液 | 往NaHCO3溶液中滴入NaOH溶液 | OH-+
|
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-==== |
查看答案和解析>>
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关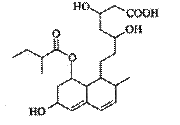 于普伐他汀的描述正确的是
于普伐他汀的描述正确的是
A.分子中含有3种官能团
B.可发生加成反应、氧化反应
C.在水溶液中羧基和羟基均能电离出H+
D.1 mol该物质最多可与l molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。请根据上述信息回答:
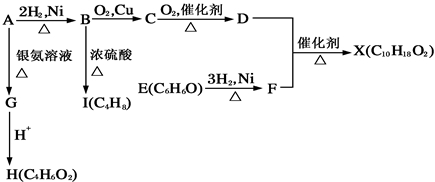
请回答下列问题:
(1)H中含氧官能团的名称是 。B→I的反应类型为 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(4)D和F反应生成X的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
“莫斯科2009年7月28日电,27日夜间,位于莫斯科郊外的杜伯纳国际联合核研究所的专家们启动新元素合成实验,如果顺利的话,实验结束时将会合成门捷列夫元素周期表上的第117号新元素”。下列有关该元素的说法正确的是
A.117 g该元素原子的物质的量为1 mol B.该元素一定为非金属元素
C.该元素在地球上的含量十分丰富 D.该元素的金属性可能比非金属性更明显
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.若把H2S分子写成H3S分子,违背了共价键的饱和性
B.H3O+离子的存在,说明共价键不应有饱和性
C.所有共价键都有方向性
D.两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2A(g)+B(g)  2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1 L的密闭容器中加入0.050 mol A和0.025 mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”“减小”或“不变”);
(5)某温度下,A的平衡转化率(α)与体系总压强(p)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(a) K(b)(填“>”“<”或“=”)。
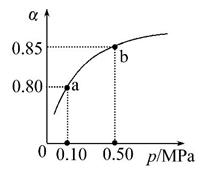
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com