
【题目】(1)给定条件下的下列四种物质:①常温下112mL液态水,②含有40mol电子的NH3, ③含有16NA个共价键的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00g/L,则该气体中氧气和甲烷的体积比为________。
(3)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL, 则所得溶液中溶质物质的量浓度是________ mol/L 。
(4)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
【答案】 ①>②>③>④ 2:3 1000ρv/(17v+22400) 2mol/L
【解析】(1)根据N=nNA判断,即物质的量越多,分子数越多;
(2)根据标况下混合气体的密度计算摩尔质量,然后利用摩尔质量的含义解答;
(3)根据c=n/V计算;
(4)根据氢氧化钠的物质的量计算氢离子的物质的量,利用氯化钡计算硫酸根离子的物质的量,然后利用电荷守恒计算氯离子浓度。
(1)①常温下112mL液态水,质量为112g,物质的量为112g÷18g/mol=6.2mol;②含有40mol电子的NH3的物质的量为40mol÷10=4mol;③1个乙醇分子含有8个共价键,含有16NA个共价键的乙醇的物质的量为2mol;④4g氦气的物质的量为1mol,物质的量越大,含有的分子数越多,则上述物质中所含分子数目由多到少的顺序为①>②>③>④;
(2)混合气体的平均摩尔质量为1.00g/L×22.4L/mol=22.4g/mol,令氧气、甲烷的物质的量分别为xmol、ymol,则(32x+16y)/(x+y)=22.4,整理可得x:y=2:3,即该气体中氧气和甲烷的体积比为2:3;
(3)标准状况下VL氨气的物质的量为V/22.4 mol,质量为17V/22.4 g,溶解在1L水中,所得溶液的质量为17V/22.4g+1000g,体积为:![]() ,因此该溶液的溶质的物质的量浓度为:
,因此该溶液的溶质的物质的量浓度为:![]() ;
;
(4)混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,一份加氢氧化钠溶液时发生反应H++OH-=H2O,由方程式可知每份溶液中n(H+)=n(OH-)=0.2mol;另一份加BaCl2溶液发生反应Ba2++SO42-=BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=0.05mol,由电荷守恒可知每份中n(H+)=2n(SO42-)+n(Cl-),故每份中溶液n(Cl-)=0.2mol-2×0.05mol=0.1mol,因此原溶液中c(Cl-)=0.1mol÷0.05L=2mol/L。


科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为探究反应后的产物,请你协助他们完成相关的实验。
[探究一]
(1)另称取铁钉(碳素钢)6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,应选用____
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学将336mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因:_________________________________________________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33g。由此推知气体Y中SO2的体积分数为_________。
[探究二]
分析上述实验中SO2体积分数的结果,两同学认为气体Y中还可能含有H2和Q气体。为此设计如图所示探究实验装置(图中夹持仪器省略)。
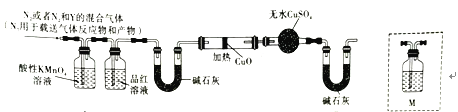
(2)装置A中发生反应的离子方程式为___________,装置B中试剂的作用是____________。
(3)认为气体Y中还含有气体Q的理由是_______________(用化学方程式表示)。为了进一步确认Q的存在,需在装置中添加装置M于______(填序号),M中所加试剂为______。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供条件推断元素,并按要求填空:
(1)第三周期中,最高价氧化物所对应水化物的酸性最强的化学式是______。
(2)原子最外层电子数是内层电子数两倍的元素,其最高价氧化物的电子式为_____。
(3)在短周期元素中,与水反应最剧烈的金属元素是____(填元素名称),离子方程式为:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO![]() 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
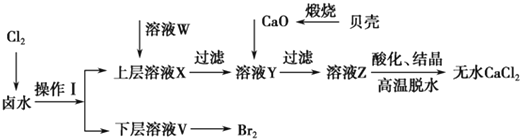
(1)操作Ⅰ使用的试剂是____________,所用主要仪器的名称是________。
(2)加入溶液W的目的是______________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是____________。酸化溶液Z时,使用的试剂为__________。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
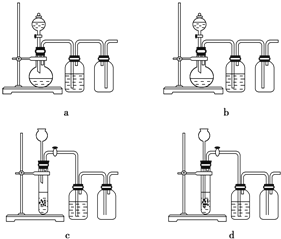
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3的酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于___________________________。用一个化学方程式表示H2SO3酸性强于H2CO3: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱组成可表示为xNa2CO3·yNaHCO3·zH2O。取m g该天然碱配成1L溶液M。取出100mLM向其中加入50mL1 mol·L-1盐酸,两者恰好完全反应生成NaCl,同时产生CO2的体积为672mL(标准状况下),下列推断正确的是( )
A. m g该天然碱中含0.3molNa2CO3 B. m g该天然碱中含0.3molNa+
C. 溶液M中c(Na+)=0.5 mol·L-1 D. 该天然碱中x:y:z=2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.非金属元素间形成的化学键一定是共价键
B.不同元素间形成的化学键一定是极性键
C.单质分子中的共价键一定是非极性键
D.化合物中的共价键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:![]()
B. Y和Z的简单氢化物的沸点:Y的氢化物![]() 的氢化物
的氢化物
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com