
【题目】1mol酯R完全水解可得到l molC5H8O4和2mol甲醇,下列有关酯R的分子式和分子结构数目正确的是
A. C7H12O4,4种 B. C7H12O4,6种
C. C7H14O2,8 种 D. C7H14O2,10种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式___________________________________,写出基态24Cr原子的价电子排布式________________________;
(2)写出基态N的原子核外电子排布图:__________________;
(3)若将基态14Si的电子排布式写成1s22s22p63s33p1,则它违背了_______________________;
(4)Fe3+比Fe2+的稳定性更________(填“强”或“弱”),从结构上分析原因是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题:
(1)写出氮元素的原子结构示意图:_____________。
(2)通常情况下,氮气性质不活泼,其原因是__________。
A.氮分子是双原子分子 B.氮元素的非金属性很强
C.氮原子的半径较小 D.破坏氮分子中的化学键很难
(3)N2的电子式:__________,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______。
A. N2和H2在一定条件下反应生成NH3
B. 雷雨闪电时空气中的N2和O2化合生成NO
C. NH3经过催化氧化生成NO
D. NH3和HNO3反应生成NH4NO3
(4)氨气的电子式:__________________。
(5)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式______________。
(6)下面是实验室制取氨气的装置和选用的试剂,其中错误的是________。
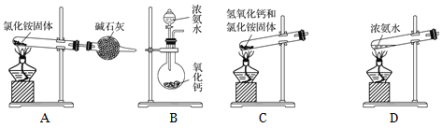
(7) 收集氨气应使用________法,要得到干燥的氨气可选用_________做干燥剂。
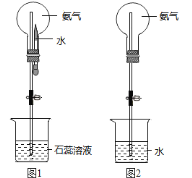
(8)用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) _________________________。
(9)如果只提供如图2的装置,请说明引发喷泉的方法__________________________。
(10)NH4NO3是常用的铵态氮肥,在施用时若受热会释放出________而降低肥效。检验NH4+的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行实验,能达到相应实验目的的是
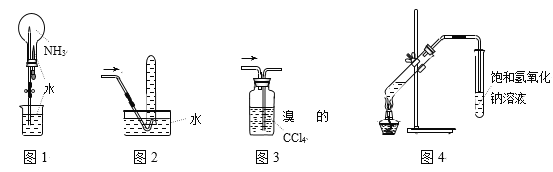
A. 用图1所示的装置进行“喷泉”实验
B. 用图2所示的装置收集少量NO2气体
C. 用图3所示的装置除去甲烷中少量乙烯
D. 用图4所示的装置制取少量的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
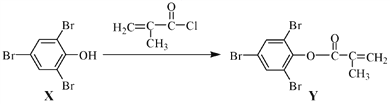
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
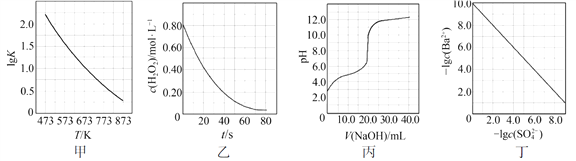
A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效多功能水处理剂。实验室模拟工业生产K2FeO4的流程如下:

(1) K2FeO4既能杀菌消毒,又能沉降水中悬浮物,其原因是:_________________________________________。
(2)无隔膜法电解饱和NaCl溶液制备NaClO总反应的离子方程式为:__________________。
(3)“氧化”时发生反应的化学方程式为:_________________________________________。Na2FeO4、FeCl3、NaClO氧化性由强到弱的顺序为_________________________________。
(4)“过滤”所得滤液中,除OH-外,一定存在的阴离子为_____________________(填离子符号)。
(5) 试从沉淀溶解平衡的角度解释“转化”得以顺利实现的原因___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com