A、B、C、D、E 5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D2C.E的单质既能与强酸反应,又能与强碱反应放出氢气.
(1)B在周期表中的位置:第 周期,第 族.
(2)C的气态氢化物的电子式 .
(3)D的最高价氧化物的水化物与E单质反应的离子方程式
.
(4)写出由这五种元素形成的某盐晶体化学式 ,它在日常生活中的作用是 .
(5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是 ;只含离子键的是 ;既含共价键又含离子键的是 (均填数字序号).
【答案】
分析:A元素所处的周期数、主族序数、原子序数均相等,应为H元素;B是地壳中含量最多的元素,应为O元素;C元素原子的最外层电子数比次外层少2个,应为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D
2C,说明D为第四周期ⅠA族元素,为K元素,E的单质既能与强酸反应,又能与强碱反应放出氢气,应为Al元素,以此解答该题.
解答:解:A元素所处的周期数、主族序数、原子序数均相等,应为H元素;B是地壳中含量最多的元素,应为O元素;C元素原子的最外层电子数比次外层少2个,应为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D
2C,说明D为第四周期ⅠA族元素,为K元素,E的单质既能与强酸反应,又能与强碱反应放出氢气,应为Al元素,
(1)B是地壳中含量最多的元素,应为O元素,位于第二周期第ⅥA族,故答案为:二,ⅥA;
(2)C元素原子的最外层电子数比次外层少2个,应为S元素,对应的氢化物为H
2S,为共价化合物,电子式为
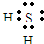
,故答案为:
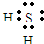
;
(3)D为第四周期ⅠA族元素,为K元素,对应的最高价氧化物的水化物为KOH,与Al反应生成偏铝酸钾和氢气,反应的离子方程式为2Al+2OH
-+2e
-=2AlO
2-+3H
2↑,
故答案为:2Al+2OH
-+2e
-=2AlO
2-+3H
2↑;
(4)这五种元素分别为:H、O、Al、S、K等元素,组成的化合物为KAl(SO
4)
2?12H
2O,常用作净水剂,
故答案为:KAl(SO
4)
2?12H
2O;净水剂;
(5)在①A
2B、②D
2B、③DBA、④B
2、⑤DACB
4、⑥D
2C这6种物质中,其对应的物质分别是①H
2O、②K
2O、③KOH、④O
2、⑤KHSO
4、⑥K
2S,
其中只含共价键的是H
2O、O
2;只含离子键的是K
2O、K
2S;既含共价键又含离子键的是KOH、KHSO
4.
故答案为:①④;②⑥;③⑤.
点评:本题考查原子结构和元素周期律的关系,题目难度中等,正确推断元素的种类为解答该题的关键.

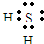 ,故答案为:
,故答案为: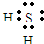 ;
;

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.