


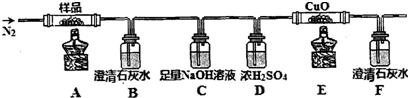
分析 以铁屑为原料制备三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O的流程:铁和硫酸反应:Fe+H2SO4=FeSO4+H2↑,硫酸亚铁和草酸反应:FeSO4+H2C2O4+2H2O=FeC2O4•2H2O+H2SO4,加入草酸钾、双氧水生成K3[Fe(C2O4)3]•3H2O.
(1)气体吸收装置中既要吸收气体又能排出不反应的气体;
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,根据硫酸亚铁溶液得到绿矾晶体的操作来回答,从溶液中得到绿矾晶体的实验操作是蒸发浓缩,冷却结晶过滤洗涤干燥;
(3)三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,A加热三草酸合铁(Ⅲ)酸钾晶体分解,B装置澄清石灰水检验二氧化碳存在,C足量氢氧化钠吸收二氧化碳,D浓硫酸干燥气体,E中有黑色氧化铜,实验现象B中有沉淀出现,则证明有二氧化碳产生,F中溶液均变浑浊,则E中发生一氧化碳还原氧化铜的反应,现象是粉末由黑色变为红色,红色固体生成,则证明有一氧化碳生成.
①根据实验原理生成的金属铜能被氧气氧化,应将装置中的空气排净,注意装置的倒吸现象;
②高锰酸钾具有氧化性,能将氯离子氧化,这样会干扰实验结果,对比三项试验方案得到结论.
解答 解:以铁屑为原料制备三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O的流程:铁和硫酸反应:Fe+H2SO4=FeSO4+H2↑,硫酸亚铁和草酸反应:FeSO4+H2C2O4+2H2O=FeC2O4•2H2O+H2SO4,加入草酸钾、双氧水生成K3[Fe(C2O4)3]•3H2O.
(1)A.该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,故A正确;
B.硫化氢与氢氧化钠接触面积较小,所以吸收不完全,故B错误;
C.没有排气装置,导致该装置内气压增大而产生安全事故,故C错误;
D.该装置中应遵循“长进短出”的原理,故D错误;
故选A;
(2)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解,绿矾晶体含有结晶水,应选择蒸发结晶,从硫酸亚铁溶液得到绿矾晶体的操作应为:蒸发浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:防止亚铁离子水解;bcae;
(3)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体一氧化碳的产生,
故答案为:排除装置中的空气,防止干扰实验结果;防止液体回流(或倒吸);CO2、CO;
②在实验方案丙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成,
故答案为:丙方案;使用盐酸溶解样品,氯离子也可以被高锰酸根离子氧化.
点评 本题考查了物质性质的实验探究,实验方案的设计与分析,主要是三草酸合铁(Ⅲ)酸钾晶体分解产物验证实验的过程分析,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:
实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-b}{b}$ | B. | $\frac{b}{a-b}$ | C. | $\frac{b-0.63a}{a-b}$ | D. | $\frac{a-b}{b-0.63a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.2mol•L-1 | B. | 5.85mol•L-1 | C. | 23.4mol•L-1 | D. | 11.7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100mL 0.1000 mol•L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com