
【题目】下列评价及离子方程式书写正确的是 ( )
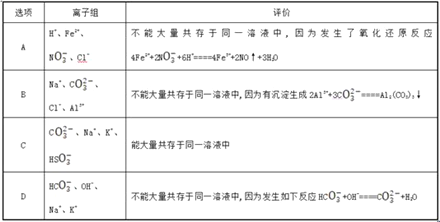
A. A B. B C. C D. D
【答案】D
【解析】分析:A.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子,评价中的离子方程式不满足电子守恒;B.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;C.碳酸氢根离子能够与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;D.碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水。
详解:A.NO3-、H+具有强氧化性,能够与Fe2+发生氧化还原反应,在溶液中不能大量共存,离子方程式书写错误,正确的离子方程式为:3Fe2++ NO3-+4H+═3Fe3++NO↑+2H2O,故A错误;
B.CO32-、Al3+之间发生反应生成氢氧化铝沉淀和二氧化碳气体,评价中离子方程式书写错误,正确的离子方程式为:2 Al3+ +6H2O +3CO32-═2Al(OH)3↓+3CO2↑,故B错误;
C.AlO2-、HCO3-之间反应生成氢氧化铝沉淀,反应的离子方程式为: AlO2-+ H2O +HCO3-= Al(OH)3↓+3CO32-,在溶液中不能大量共存,评价错误,故C错误;
D. HCO3-、OH-之间反应生成碳酸根离子和水,反应的离子方程式为: HCO3-+OH-═CO32-+ H2O,在溶液中不能大量共存,评价合理,所以D选项是正确的;因此本题选D。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学设计实验,完成了![]() 和
和![]() 溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
实验I:
| 实验现象 |
i.加入 ii.取少量i中清液于试管中,滴加2滴1 mol/L |
已知:i.![]()
ii.![]() 的性质与卤素单质相似,且氧化性:
的性质与卤素单质相似,且氧化性:![]()
(1)![]() 和
和![]() 溶液反应的离子方程式是______。
溶液反应的离子方程式是______。
(2)现象ii中溶液最终呈红色的一种可能原因是:![]() 和
和![]() 生成(SCN)2,进而使清液中的
生成(SCN)2,进而使清液中的![]() 氧化为
氧化为![]() 。设计如下实验II进行验证:
。设计如下实验II进行验证:

① 认为原因被证实的现象iii是________。
② 加入CuCl2溶液后反应的离子方程式是_________。
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如下:

① 对比实验II,说明实验III更加严谨的原因:________。
② 改进后的实验才能证实(2)中猜想,依据的上述现象是______。
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
实验IV | 现象 |
向2 mL 1 mol/L | 充分振荡,溶液红色褪去,有白色沉淀生成 |
① 实验IV中溶液红色褪去,不能说明![]() 反应完全。结合实验II或III,说明理由:_______。
反应完全。结合实验II或III,说明理由:_______。
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有![]() 的是_______(填序号)。
的是_______(填序号)。
a.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
b.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
c.选择一种只与![]() 反应的试剂,观察是否出现特征现象
反应的试剂,观察是否出现特征现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如图所示,下列有关说法不正确的是 ( )
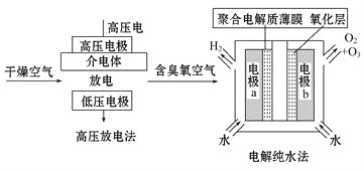
A. 高压放电法,反应的原理为3O2![]() 2O3
2O3
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D. 电解水时,H+由电极a经聚合电解质薄膜流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是

A. 原混合物中n[Ba(OH)2]:n[NaOH] =1:2
B. 横坐标轴上p点的值为90
C. b点时溶质为NaHCO3
D. ab段发生反应的离子方程式依次为:CO2+2OH- = H2O+CO32-,CO2+H2O+ CO32-=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液中,其物质的量浓度为1.0 mol/L的是( )
A. 将20 g NaOH溶解在500 mL水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
C. 将62.5 g胆矾(CuSO4·5H2O)溶解在适量水中,再加蒸馏水直到溶液的体积为250 mL
D. 将100 mL 10 mol/L的硫酸加入到900 mL水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用双线桥法表示反应中电子转移的方向和数目CuO+H2![]() Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
(2)用双线桥法表示反应中电子转移的方向和数目2Na+Cl2![]() 2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
(3)配平下列氧化还原反应方程式:
①____HNO3![]() ____H2O+____NO2↑+____O2↑;
____H2O+____NO2↑+____O2↑;
②____Cl2+____KOH=____KCl+____KClO3+____H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CH4(g)+H2O(g)CO(g)+3H2(g)(正反应吸热),一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是( )
A. 升高温度B. 增大水蒸气浓度C. 加入催化剂D. 降低压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com