

分析 (1)①人类使用最广泛的金属是铁;根据化学平衡常数表达式书写,固体纯液体不写入式子;②根据化学反应速率v=$\frac{△C}{△t}$计算.
(2)可逆反应达到平衡状态时,各物质的浓度不再变化,正反应速率与逆反应速率相等.
(3)N为Al元素,金属氧化物与单质Al在镁条的引燃下发生铝热反应,铝热反应为放热反应,温度身高,反应速率加快,由此得答案.
(4)氢氧化铝是弱电解质,在水中不会完全电离;根据影响化学平衡移动的因素,可找到使平衡正向移动的物质.
解答 解:人类使用最广泛的金属是铁,氧化物和氢氧化物具有两性的是铝,所以M为铁,N为铝.
(1)①人类使用最广泛的金属是铁,所以M为铁元素;化学平衡常数为生成物浓度幂之积与反应物浓度幂之积,固体与纯液体不写,三氧化二铁与铁是固体不写,所以 k=$\frac{c^3(C{O}_{2})}{c^3(CO)}$;
故答案为:铁;$\frac{c^3(C{O}_{2})}{c^3(CO)}$;
②生成单质铁的质量为11.2g,则n(铁)=$\frac{11.2g}{56g/mol}$=0.2mol,则参与反应的CO的物质的量的n(CO)=$\frac{3×0.2}{2}mol$=0.3mol,由公式v(CO)=$\frac{△C}{△t}$=$\frac{0.3mol÷2L}{10min}$=0.0015mol•L-1•min-1,
故答案为:0.0015mol•L-1•min-1;
(2)可逆反应达到化学平衡状态时,①各组分浓度保持不变,②正反应速率与逆反应速率相等,固体不做考虑.
故答案为:①CO(或CO2)的浓度不再变化;②CO(或CO2)的生成速率消耗速率相等;
(3)N为铝,即该反应为铝热反应,反应需要加热进行,所以一开始速率为零,随着反应的进行,铝热反应放热,温度升高,反应速率加快,b正确.
故答案为:b;
(4)氢氧化铝是弱电解质,不能完全电离,所以它的碱式电离为:Al(OH)3?Al3++3OH-;欲使铝离子浓度增大,可以消耗生成物OH-是平衡正向移动,铝离子浓度变大,所以可以加盐酸.
故答案为:Al(OH)3?Al3++3OH-;盐酸.
点评 本题考查了铝与铁的性质,主要考查了化学平衡状态的判断,影响化学平衡移动和反应速率的因素,计算中注意单位.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
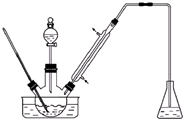 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com