
【题目】在含有大量H+、Mg2+、SO42-的溶液中,还可能大量共存的离子是( )
A. Ba2+ B. OH- C. CO32- D. Fe2+
科目:高中化学 来源: 题型:
【题目】锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________(填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
试管编号 | 实验现象 |
A | 溶液不变色 |
B | 溶液缓慢变浅棕褐色 |
C | 溶液迅速变棕褐色 |
①从以上实验中,我们可以得出的结论是_____________________。
②写出C试管中发生反应的离子方程式:_______________________。
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:

已知:Fe3+、Mn2+沉淀的pH如表格所示。
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 4.2 |
Mn2+ | 8.3 | 10.4 |
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________。
步骤二中需控制pH的范围是_________________。
步骤三中是否洗涤干净的判断方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.《化学与生活》
(1)南通是“世界长寿之都”。合理饮食,正确使用药物对人体健康至关重要。
①下列途径不属于补充人体必需的微量元素的是__________(填字母)。
a.乳制品补钙 b.海产品补碘 c.肉制品补硒
②某品牌饼干的配料标签如图所示,下列法正确的是 _________(填字母)。

a.苯甲酸钠是一种着色剂
b.小麦粉中的主要营养物质是葡萄糖
C.食用植物油在人体内水解生成高级脂肪酸和甘油
③“是药三分毒”说明药物在人体内可能产生不良反应,下列药物可能引起的不良反应叙述错误的是__________(填字母)。
a.青霉素一一过敏反应 b.阿司匹林——胃肠道反应
c.复方氢氧化铝——肠胃穿孔
(2)南通地铁2017年底开工建设,工程建设需要大量水泥、钢铁等材料。
①工业上生产水泥的主要原料是黏土和__________,地铁信息传输系统中使用的光导纤维主要成分是 __________。
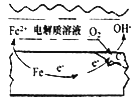
②钢铁在潮湿的空气中易发生吸氧腐蚀(如右图), 正极电极反应式为_____________。
③复合材料“钙塑板”质轻、消声、隔热,以高压聚乙烯、轻质碳酸钙及少量助剂为原料压制而成,聚乙烯的结构简式为__________。
(3)环境友好型城市建设是南通城市规划(20112020年)重点之一。
①2016年,南通市机动车保有量超过200万辆,在机动车尾气系统中装置催化转化器,可将尾气中的NO、CO转化为无害的CO2和__________。
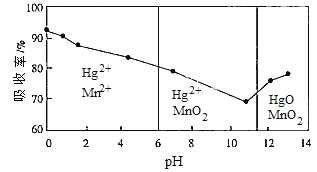
②锌锰电池含有的微量汞单质可用KMnO4吸收液处理。常温下,汞的吸收率及主要反应产物与吸收液的pH的关系如下图。为降低吸收后溶液中Hg2+的浓度,吸收过程中pH> __________。当吸收液的pH<6时,Hg与KMnO4溶液反应的离子方程式为________________。
③脱硫、脫碳是指将燃煤中产生的SO2、CO2去除,减少其排放的过程。向煤中加入适量生石灰,可大大减少SO2的排放,并可回收得到_______________;CO2和H2在催化剂及髙温、高压条件下可以合成乙醇,该反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取CO2。下列说法错误的是

A. 关闭活塞,向长颈漏斗中加水可检査装置的气密性
B. 通常用稀盐酸和块状石灰石反应
C. 旋转活塞可以控制反应的进程
D. 用澄清石灰水可除去CO2中混有的HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是含氧酸,第二种是强电解质,第三种是混合物的是
A.水、纯碱、空气 B. H2SO4、NaCl、烟
C. HNO3、盐酸、碱石灰 D.Fe2O3、BaSO4、饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ⅰ)表示反应:mA(g)+nB(g) ![]() pC(g)+qD(g);△H。在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变影响平衡的另一个条件,重新建立平衡的反应过程。由此可判断该反应中
pC(g)+qD(g);△H。在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变影响平衡的另一个条件,重新建立平衡的反应过程。由此可判断该反应中
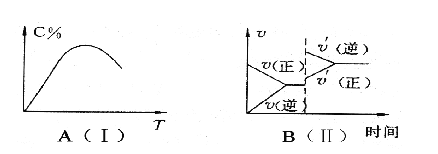
A. m+n>p+q, ![]() <0
<0
B. m+n>p+q, ![]() >0
>0
C. m+n<p+q, ![]() >0
>0
D. m+n<p+q, ![]() <0
<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2 240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com