
300��ʱ����2 mol A��2 mol B������������2 L�ܱ������У��������·�Ӧ��3A(g)+B(g)![]() 2C(g)+2D(g) ��H=Q��2 minĩ�ﵽƽ�⣬����0.8 mol D��
2C(g)+2D(g) ��H=Q��2 minĩ�ﵽƽ�⣬����0.8 mol D��
(1�÷�Ӧ��ƽ�ⳣ������ʽΪ��K=������������������������֪K300��<K350���� ��#��#��#Դ#
���H����������0(�>����<��)��
(2)��2 minĩʱ��B��ƽ��Ũ��Ϊ������������D��ƽ����Ӧ����Ϊ����������������
(3)���¶Ȳ��䣬��С�����ݻ�����A��ת��������������(�����С���� �����䡱)��
ԭ������������������������������������������������
(4)�������ͬ�������£�������Ӧ���淴Ӧ������У���ʼʱ������C��D��![]() mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B ����������mol��
mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B ����������mol��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ����̿ |
| 1 |
| c(SO2)?c(Cl2) |
| 1 |
| c(SO2)?c(Cl2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ɽ��ʡʤ������һ��2012�������ѧ�ڵ�һ�ε��п��Ի�ѧ���� ���ͣ�022
��ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ��һ���������Ʊ�����ȼ�ϼ״�����Ӧ���£�
��CH4(g)��H2O(g)![]() CO(g)��3H2(g)����H1
CO(g)��3H2(g)����H1
��CO(g)��2H2(g)![]() CH3OH(g)����H2
CH3OH(g)����H2
�밴Ҫ��ش��������⣺
(1)��0.20 mol��CH4��0.30 mol��H2O(g)ͨ���ݻ�Ϊ2 L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱCH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ�����¶Ȳ�����С���ʱ�˷�Ӧ���淴Ӧ����(���������С�����䡱)________����H1________0��p1________p2(�������������������)��p1��100��ʱƽ�ⳣ����ֵK��________��
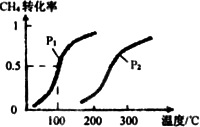
(2)Ϊ��̽����Ӧ�ںϳɼ״����˵��¶Ⱥ�ѹǿ��ijͬѧ�������������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��У����ڿո�������ʣ���ʵ���������ݣ�
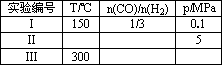
����300��ʱ�����������䣬���÷�Ӧ�����ݻ�ѹ����ԭ����1/2������ƽ��ʱCH3OH�����ʵ����ı仯��________��K�ı仯��________(�����������С�����䡱)��
(3)��֪�ڳ��³�ѹ�£�2CH3OH(I)��3O2(g)![]() 2CO2(g)����H����1275.6 kJ/mol
2CO2(g)����H����1275.6 kJ/mol
H2O(g)��H2O(I)����H����44.0 kJ/mol�������32 g����ȼ�ϼ״���ȫȼ������Һ̬ˮ�ų�����Ϊ________kJ��
(4)����ȼ�ϼ״�����������ȼ�յ�أ��䷴Ӧԭ������ͼ��ʾ����ع���ʱ�����ƶ�������(������M��N��ʾ)________�������缫��ӦʽΪ________��
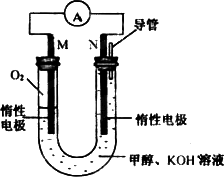
���Ը�ȼ�ϵ����Ϊ��Դ����ʯī���缫���500 mL����ʳ��ˮ�����������ռ���1.12 L(��״���¡�������������ܽ⼰��Ӧ)ʱ��������������Һ��pH��________(���跴Ӧǰ����Һ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(X)/ mol��L-1 | c(Y)/ mol��L-1 | v/ mol��L-1��s-1 |
1 | 0.10 | 0.10 | 4.0��10-4 |
2 | 0.20 | 0.10 | 1.6��10-3 |
3 | 0.30 | 0.10 | 3.6��10-3 |
4 | 0.30 | 0.20 | 7.2��10-3 |
��������ʵ�����ݣ�����������⣺
��1��������Ӧ��
��2����c(X)=c(Y)=0.25 mol��L-1ʱ��v=_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
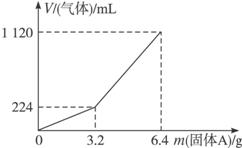
��1��3.2 g����A��������������__________�������ʵ����ʵ����ֱ�Ϊ__________���������������ַ�Ӧ��������Һ�����ʵ����ʵ���Ũ��Ϊ��������Һ����仯��__________��
��2��������Aȫ�������������ᣬ��A������m��3.2 gʱ���ռ����������������״���£�V��__________mL���ú�m�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣���ͭ�����Ҫ�ɷ�X����Cu��Fe��S����Ԫ����ɵĸ��Σ�����Cu��Fe����Ԫ�ص�������Ϊ8��7����m g X��ĩȫ������200 mL��ŨHNO3����Ӧ�����Һ��ˮϡ�� 2.12 Lʱ�����pH��0����ϡ�ͺ����Һ��Ϊ���ȷݣ�������һ����Һ�еμ�Ũ��Ϊ6. 05 mol/L��NaOH��Һ������һ����Һ�еμ�0.600 mol/L Ba(NO3)2��Һ������Һ�о����ɳ������ҳ�����������������Һ������仯����ͼ��ʾ��
��1����ͨ������ȷ����m��________��
��2��X��Ħ������Ϊ368 g/mol����X�Ļ�ѧʽΪ________________��
��3����һ��������Fe��Cu�Ļ����ƽ���ֳ��ĵȷݣ�ÿ��13.2 g���ֱ����ͬŨ�ȵ�ϡ���ᣬ��ַ�Ӧ���ڱ�״��������NO�������ʣ��������������±���������Ļ�ԭ����ֻ��NO����
| ʵ���� | �� | �� | �� | �� |
| ϡ�������/mL | 100 | 200 | 300 | 400 |
| ʣ���������/g | 9.0 | 4.8 | 0 | 0 |
| NO���/L | 1.12 | 2.24 | 3.36 | V |
�ش��������⣺
��д��ʵ����з�����Ӧ�����ӷ���ʽ___________________________________��
��ʵ�����V��________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com