
【题目】写出下列反应的化学方程式:
(1)丙烯制备聚丙烯:______;
(2)2-甲基-1,3-丁二烯与Br2的1,4-加成反应______;
(3)1,2-二溴乙烷在氢氧化钠、乙醇中加热______;
(4)实验室制备乙炔气体:______;
【答案】![]() CH2=C(CH3)-CH=CH2+Br2→CH2Br-C(CH3)=CH-CH2Br CH2BrCH2Br+2NaOH
CH2=C(CH3)-CH=CH2+Br2→CH2Br-C(CH3)=CH-CH2Br CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O CaC2+2H2O→CH≡CH↑+Ca(OH)2
CH≡CH↑+2NaBr+2H2O CaC2+2H2O→CH≡CH↑+Ca(OH)2
【解析】
(1)丙烯制备聚丙烯发生的是加聚反应,其反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)2-甲基-1,3-丁二烯与Br2发生1,4-加成反应的方程式为CH2=C(CH3)-CH=CH2+Br2→CH2Br-C(CH3)=CH-CH2Br,故答案为:CH2=C(CH3)-CH=CH2+Br2→CH2Br-C(CH3)=CH-CH2Br;
(3)1,2-二溴乙烷在氢氧化钠、乙醇中加热发生消去反应,其反应方程式为CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O,故答案为:CH2BrCH2Br+2NaOH
CH≡CH↑+2NaBr+2H2O,故答案为:CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O;
CH≡CH↑+2NaBr+2H2O;
(4)实验室制备乙炔气体,用电石和水反应,其反应方程式为CaC2+2H2O→CH≡CH↑+Ca(OH)2,故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将一小块钠放在石棉网上加热。回答下列问题:
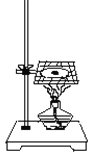
(1)观察到的实验现象有:____________________________________和黑色固体物质生成。
(2)产生以上现象的主要化学反应方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,H2和O2在Ag9(图中物质1)团簇上生成H2O2的吉布斯自由能(![]() )的部分变化曲线如图。下列说法错误的是( )
)的部分变化曲线如图。下列说法错误的是( )
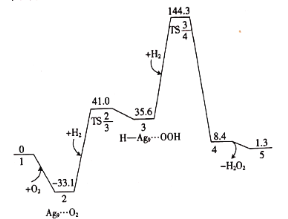
A.物质2中的O2是处于被吸附活化状态
B.物质3→物质4的过程中活化吉布斯自由能能垒为![]()
C.物质4可能为![]()
D.反应![]() 具有自发性
具有自发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以![]() 、天门冬氨酸(
、天门冬氨酸(![]() )为原料制备。回答下列问题:
)为原料制备。回答下列问题:
(1)Zn成为阳离子时首先失去______轨道电子。碲(Te)与O同主族,则Te元素中电子占据的能量最高的能级是______。
(2)P是N的同族元素,PH3与NH3中稳定性更高的是______(填化学式),其判断理由是______;酞菁铜可用于生产蓝色颜料(结构如图),其中C原子的轨道杂化类型为______。
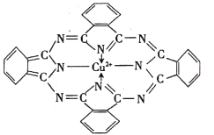
(3)CO为______(填“极性”或“非极性”)分子。
(4)ZnO晶体的一种晶胞结构如图:
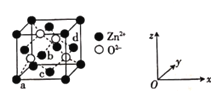
①![]() 的配位数为____________。
的配位数为____________。
②以晶胞边长为单位长度建立的坐标系可表示晶胞中锌原子的位置,称作原子分数坐标。图中原子a的分数坐标为![]() ,原子d的分数坐标为
,原子d的分数坐标为![]() ,则原子b和c的分数坐标分别为______、______。
,则原子b和c的分数坐标分别为______、______。
③设![]() 为阿伏加德罗常数的值。已知晶胞边长为
为阿伏加德罗常数的值。已知晶胞边长为![]() nm,则ZnO晶体的密度为______(列出计算式)
nm,则ZnO晶体的密度为______(列出计算式)![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸H2A为二元弱酸.20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
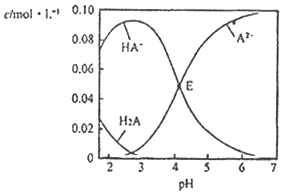
A.pH=2.5的溶液中:c(H2A)+c(A2﹣)>c(HA﹣)
B.c(Na+)=0.100moLL﹣1的溶液中:c(H+)+c(H2A)=c(OH﹣)+c(A2﹣)
C.c(HA﹣)=c(A2﹣)的溶液中:c(Na+)>0.100molL﹣1+c(HA﹣)
D.pH=7.0的溶液中:c(Na+)<2c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳酸:H2CO3,K1=4.3×10﹣7,K2=5.6×10﹣11
草酸:H2C2O4,K1=5.9×10﹣2,K2=6.4×10﹣5
0.1mol/L Na2CO3溶液的pH_____0.1mol/L Na2C2O4溶液的pH;(选填“大于”“小于”或“等于”)
(2)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是_____;若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____(选填编号);
a.c(H+)>c(HC2O![]() )>c(HCO
)>c(HCO![]() )>c(CO
)>c(CO![]() )
)
b.c(HCO![]() )>c(HC2O
)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(CO
)>c(CO![]() )
)
c.c(H+)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(CO
)>c(CO![]() )
)
d.c(H2CO3)>c(HCO![]() )>c(HC2O
)>c(HC2O![]() )>c(CO
)>c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳有多种单质,其中石墨烯与金刚石的晶体结构如图所示:
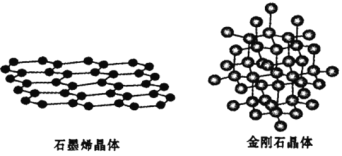
石墨烯能导电而金刚石不能导电的原因是________。
(2)碳的主要氧化物有CO和CO2
①CO能与金属Fe形成一种浅黄色液体Fe(CO)5,其熔点为-20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:该化合物的晶体中不涉及的作用力有________。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②CO2在一定条件下可以合成甲醇,反应方程式为:![]() 。该反应所涉及的4种物质,沸点从高到低的顺序为________。
。该反应所涉及的4种物质,沸点从高到低的顺序为________。
(3)![]() 是重要的有机反应中间体,其空间构型为________。
是重要的有机反应中间体,其空间构型为________。
(4)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。
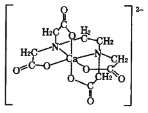
①钙离子的配位数是________。
②配体中碳原子的杂化方式有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
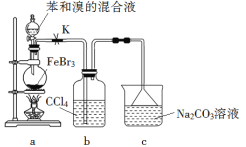
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com