
【题目】已知氧化性Br2>Fe3+>I2,向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如下图所示,下列说法中正确的是( )
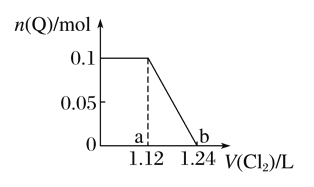
A. Q是I-
B. Q是Br-
C. b点时溶液中阴离子只有Cl-(不考虑OH-)
D. ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
【答案】D
【解析】离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-;A.若Q是I-,2I-+Cl2=I2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,标准状况下为1.12L,此时碘离子为0,而图象中通入氯气为1.12L时,碘离子仍为0.1mol,与实际不符合,故A错误;B.若Q是Br-,I-、Fe2+完全反应后,才发生2Br-+Cl2=Br2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,0.1molFe2+完全反应消耗0.05mol氯气,故开始反应时氯气的体积为2.24L,图象中氯气的体积不符合,故B错误;C.根据C可知:b点时溶液中有Cl-,Fe3+、Br-,故C错误;D.离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,0.1molI-完全反应消耗0.05mol氯气,开始反应时氯气的体积为1.12L,0.1molFe2+完全反应消耗0.05mol氯气,此时氯气的体积为2.24L,所以ab区间的反应:2Fe2++Cl2═2Fe3++2Cl-,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:
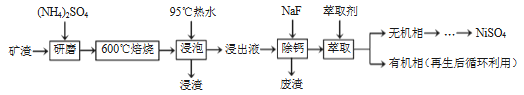
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2)"浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
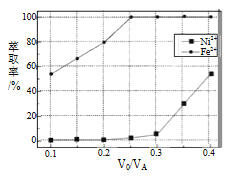
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH![]() C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa
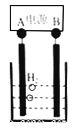
下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验的叙述中,正确的是( )
A. 蒸馏操作时应将温度计的水银球插入液面下
B. 制乙酸乙酯时,将乙醇沿器壁注入浓硫酸中
C. NaOH溶液可以保存在带橡胶塞的试剂瓶中
D. 用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
聚芳酯(PAR)在航空航天等领域具有广泛应用。下图是合成某聚芳酯的路线:
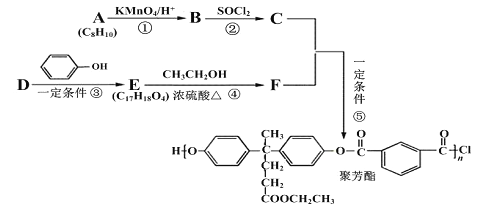
已知: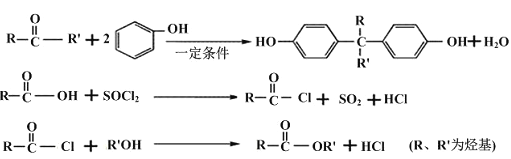
(1)A的名称为______________________,B的结构简式是_________________________。
(2)D的分子式为_______________________,反应④的反应类型是________________。
(3)写出⑤的化学方程式为_________________________。
(4)M是符合下列条件的B的同分异构体
a.能发生银镜反应、水解反应,还能与Na2CO3溶液反应
b.苯环上只有两个取代基且无“—O—O—”结构
c.能与FeCl3发生显色反应
则M共有_______种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本福岛核电站泄漏的核燃料衰变产物有放射性元素![]() 、
、![]() 等,其中
等,其中![]() 是个双刃剑,医院可以用它来治疗甲状腺癌;但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是
是个双刃剑,医院可以用它来治疗甲状腺癌;但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是
A. 碘131I原子核所含中子数是78
B. 核能的利用证实原子的可分性
C. 碘127I原子和放射性碘原子131I属于同位素
D. 碘127I原子和碘131I原子的质子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_________。
②Ⅱ中发生了分解反应,反应的化学方程式是_________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计试验Ⅳ进行探究(如图1):
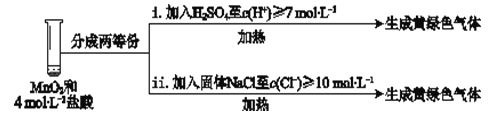
将实验Ⅲ、Ⅳ作对比,得出的结论是_______;将实验现象Ⅳ中的i、ii作对比,得出的结论是_______。
④用如图装置(a、b均为石墨电极)进行实验Ⅴ:
ⅰ、K闭合时,指针向左偏转
ⅱ、向右管中滴加浓H2SO4至c(H+)>7mol/L,指针偏转幅度变化不大
ⅲ、再向左管中滴加浓H2SO4至c(H+)>7mol/L,指针向左偏转幅度增大
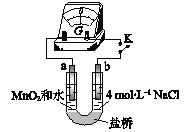
将实验V中的ⅰ和ⅱ、ⅲ作对比,得出的结论是___________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸___________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,在加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是_________。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | 试纸先变蓝,不褪色 |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧后得到的氧化产物:![]()
B. 铁在Cl2中燃烧后得到的氧化产物:![]()
C. FeBr2溶液中通入Cl2,铁元素存在形式:![]()
D. NH3与Cl2反应,反应产物:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]3H2O)有很重要的用途.可用如图流程来制备.根据题意完成下列各题:
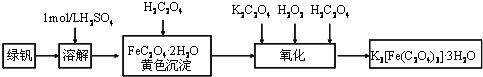
(1)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填写)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4﹣被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4﹣,被还原成Mn2+.
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;
主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(3)步骤2中,加入锌粉的目的是 .
(4)步骤3中,发生反应的离子方程式为: .
(5)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体(是物质的量之比为4:5的混合气体).研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com