
| A�� | W��X�γɵĻ�������ܺ��зǼ��Թ��ۼ� | |
| B�� | X��Z�γɵĻ����ﳣ����Ϊ��̬ | |
| C�� | W��X��Y��Z����Ԫ����ɵĻ������ˮ��Һ���ܳ����� | |
| D�� | W��X��Y��Z����Ԫ������֮������γɶ�Ԫ������ |
���� W��X��Y��Z��ԭ��������������Ķ�����Ԫ�أ�W��ԭ�Ӱ뾶��С�Ķ�����Ԫ�أ���WΪH��W��Yͬ���壬YΪNa��X��Zͬ���壬��X��Z��ԭ������֮����W��Yԭ������֮�͵�2������X��ԭ������Ϊx����x+x+8=��1+11����2�����x=8����XΪO��ZΪS���Դ������
��� �⣺������������֪��WΪH��XΪO��YΪNa��ZΪS��
A��W��X�γɵĻ�������ܺ��зǼ��Թ��ۼ�����H-O-O-H����A��ȷ��
B��X��Z�γɵĻ�����ΪSO2��������Ϊ���壬��ΪSO3ʱΪ��̬����B����
C��W��X��Y��Z����Ԫ����ɵĻ�����ΪNaHSO4��NaHSO3�����ˮ��Һ�����ԣ���C��ȷ��
D��W��X�γ�H2O��H2O2��Y��Z�γ�Na2S��W��Y�γ�NaH��W��Z�γ�H2S��X��Y�γ�Na2O��Na2O2��X��Z�γ�SO2��SO3����D��ȷ��
��ѡB��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɣ�Ϊ��Ƶ���㣬����Ԫ�ص�λ�á�ԭ�������ƶ�Ԫ��Ϊ���Ĺؼ������ط������ƶ������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڿ������п������ƣ���������䰵��2Na+O2�TNa2O2 | |
| B�� | ���Ȼ�����Һ�м��������ˮ��������ɫ������Al3++3OH-�TAl��OH��3 | |
| C�� | ��������ˮ�������ȣ��������壺2Fe+3H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$ Fe2O3+3H2�� | |
| D�� | Al2O3 ��ĩ���� NaOH ��Һ�У�Al2O3+2OH-�T2AlO2-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | |||
| Z | W | Q |
| A�� | ���Ӱ뾶�Ĵ�С˳��Ϊr��Q-����r��W2-����r��Z3+����r��Y2-�� | |
| B�� | X��Q���⻯�ﻯ�ϵIJ����мȺ����ۼ��ֺ����Ӽ� | |
| C�� | Y�⻯��ķе��W�⻯��ķе�� | |
| D�� | X��Z��W��Q������������Ӧ��ˮ���������ǿ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
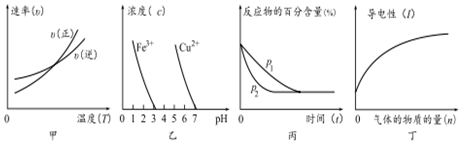
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L Cl2������ˮ��Ӧ��ת�Ƶĵ�����Ŀ����NA | |
| B�� | 17 g-18OH�����ĵ�����ĿΪ9NA | |
| C�� | 16 g N2 H4�к��еķǼ��Թ��ۼ���ĿΪ0.5NA | |
| D�� | ����ʱ��1 L pH=12�� Ba��OH��2��Һ�к�OHһ����ĿΪ2��10-2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
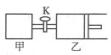 ��ͼ��ʾ���رջ�������ס����������ܱ������зֱ����1mol A��2mol B����ʱ�ס��ҵ��ݻ���Ϊ2L����ͨ��������Բ��ƣ�����T��ʱ���������о�����������Ӧ��A��g��+2B��g��?2C��g��+3D��g������H��0����ƽ��ʱ���ҵ����Ϊ2.6L������˵����ȷ���ǣ�������
��ͼ��ʾ���رջ�������ס����������ܱ������зֱ����1mol A��2mol B����ʱ�ס��ҵ��ݻ���Ϊ2L����ͨ��������Բ��ƣ�����T��ʱ���������о�����������Ӧ��A��g��+2B��g��?2C��g��+3D��g������H��0����ƽ��ʱ���ҵ����Ϊ2.6L������˵����ȷ���ǣ�������| A�� | ���з�Ӧ��ƽ�ⳣ��С���� | |
| B�� | ������A��B���������֮��Ϊ1��2ʱ����Ӧ�ﵽƽ��״̬ | |
| C�� | ƽ��ʱ��������A�����ʵ���С��0.55 mol | |
| D�� | ������K����ƽ��ʱ�����������Ϊ3.2 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO32- | B�� | AlO2- | C�� | Ca2+ | D�� | Ag+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 44.43KJ | B�� | 88.85kJ | C�� | 133.28KJ | D�� | 177.70kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ��H+��Fe2+��SCN-��Br-���Դ������� | |
| B�� | ����Һ�е�������NaOH��Һ��3NH4++Fe3++6OH-=3NH3��+Fe��OH��3�� | |
| C�� | ����Һ�м���������Zn�ۣ�2Fe3++Zn=Zn2++2Fe2+ | |
| D�� | �ȼ������ټ���BaCl2��Һ��SO42-+Ba2+=BaSO4�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com