
| A. | 油脂酸败 | B. | 石油裂解 | C. | 钢铁生锈 | D. | 干冰升华 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断.
解答 解:A.油脂酸败:发生了氧化反应,有新物质生成,属于化学变化,故A错误;
B.石油裂解:分子量较大的烃分解生成分子量较小的烃,有新物质生成,属于化学变化,故B错误;
C.钢铁生锈:铁被氧化生成氧化物,有新物质生成,属于化学变化,故C错误;
D.干冰升华:由固体变为气体,没有新物质生成,属于物理变化,故D正确;
故选D.
点评 本题考查物理变化与化学变化的判断,难度不大.要注意化学变化和物理变化的本质区别是否有新物质生成,侧重于考查学生的分析能力和应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有氯化铁杂质的氯化铜溶液中加入铜 | 除去氯化铁杂质 |
| B | 向某溶液中加入盐酸话的氯化钡溶液 | 效验SO${\;}_{4}^{2-}$的存在 |
| C | 常温下,用pH计测定NaHCO3溶液的pH | 比较HCO${\;}_{3}^{-}$水解、电离程度的相对大小 |
| D | 将SO2通入Ba(NO3)2溶液中 | 证明BaSO3不溶于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ=$\frac{(36.5V+22400)c}{V}$ | B. | c=$\frac{1000Vρ}{36.5V+22400}$ | ||
| C. | V=$\frac{22400ω}{36.5(1-ω)}$ | D. | ρ=$\frac{36.5c}{1000ω}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与CH3COOH溶液反应:Zn+2H+═Zn2++H2↑ | |
| B. | 氢氧化铝与稀硝酸反应:H++OH-═H2O | |
| C. | CuCl2溶液与铁粉反应:3Cu2++2Fe═3Cu+2Fe3+ | |
| D. | MgCl2溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
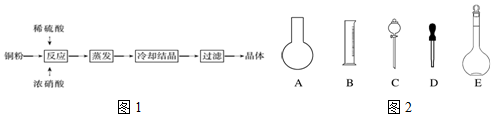
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com