
| A. | 胶体区别于其它分散系的本质特征是分散质微粒直径在10-9 m~10-7m之间 | |
| B. | 用聚光手电筒照射CuSO4溶液和Fe(OH)3胶体时,产生的现象相同 | |
| C. | 将5-6滴饱和FeCl3溶液加入到沸水中继续加热至溶液呈红褐色制得了Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
分析 A、根据分散系的根本区别进行判断;
B、胶体有丁达尔效应;
C、将饱和氯化铁溶液滴入沸水中能制得氢氧化铁胶体;
D、氢氧化铁胶体有吸附作用.
解答 解:A、分散系的根本区别在于分散质微粒直径的大小,小于100nm为溶液,大于100nm为浊液,在1nm~100nm的为胶体,故A正确;
B、胶体有丁达尔效应,而溶液没有,故用聚光手电筒照射CuSO4溶液和Fe(OH)3胶体时,产生的现象不同,故B错误;
C、将饱和氯化铁溶液滴入沸水中,继续煮沸,至溶液变为红褐色时停止加热,即能制得氢氧化铁胶体,故C正确;
D、氢氧化铁胶体有吸附作用,能吸附水中的杂质,故能净水,故D正确.
故选B.
点评 本题考查了胶体的性质和制备,难度不大,应注意的是胶体和其他分散系的本质区别是分散质粒子直径大小,而不是丁达尔效应.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
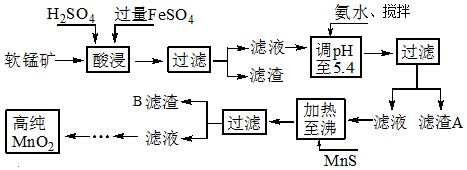
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 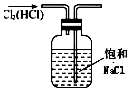 用图所示装置可得到纯净的Cl2 | |
| B. | 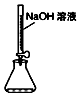 用图量取15.00mL的NaOH溶液 | |
| C. | 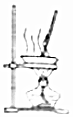 用图所示装置蒸发FeCl3溶液制备无水FeCl2 | |
| D. |  关闭分液漏斗的活塞,从b处加水,以检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
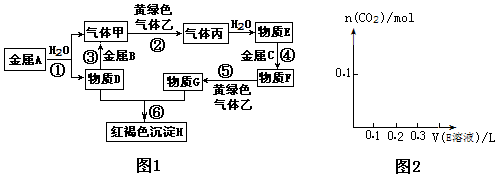
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热 | |
| B. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 苹果放在空气中久置变黄和纸张久置变黄原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
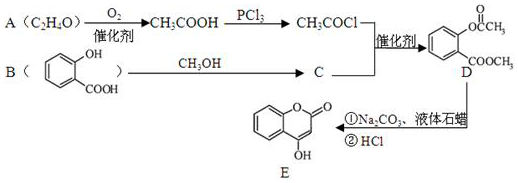
 .
.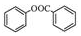 )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com