
| A. | 0 | B. | 2 | C. | 3 | D. | 8 |
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ④⑥ | C. | ③⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+ | |
| B. | 用干燥的pH试纸可测得新制氯水的pH=2 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 食盐中的碘可以直接用淀粉检验其是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
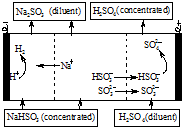 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )| A. | 阳极区酸性增强 | |
| B. | diluent和concentrated的中文含义为浓缩的、稀释的 | |
| C. | 阴极区连接的是阳离子交换膜 | |
| D. | 该过程中的副产品主要为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
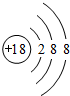 .
.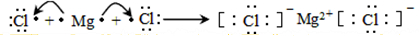 .
. ,该化合物分子内含有极性键(填“极性”或“非极性”).
,该化合物分子内含有极性键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ②③④⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com