

���� ��1��NaH��һ��������������ӻ����NaH��H2O��Ӧ�ų�H2������Ԫ�ط����Ĺ��з�Ӧ��
��2��������������������С�ķ��ȷ�Ӧ����ϻ�ѧƽ���ƶ�ԭ�������ж���Ҫ���ʵ�������
��3�����������仯ͼ����Ӧ�ϼ�������2��630+2��436=2132kJ���γɹ��ų�945+4��463=2797kJ�����Ը÷�Ӧ���ų�2797-2132=665kJ���������ݴ���д��
��4���ݻ�ѧƽ������ʽ��ʽ���㣬
ƽ��״̬c��H2��=c��CH4��=0.8mol/L��c��CO2��=0.2mol/L��
CO2��g��+4H2��g��?CH4��g��+2H2O��g��
��ʼ����mol/L�� 1.0 4.0 0 0
�仯����mol/L�� 0.8 3.2 0.8 1.6
ƽ������mol/L�� 0.2 0.8 0.8 1.6
�ٷ�Ӧ����V=$\frac{��c}{��t}$���㣻
�ڸ���ƽ�ⳣ��Ϊ������Ũ�ȵ��ݴη�֮�����Ϸ�Ӧ��Ũ�ȵ��ݴη�֮����д���Ƚ�300����200��ʱ��ƽ�ⳣ��K��ֵ�жϷ�Ӧ�ġ�H��
��� �⣺��1��NaH��һ��������������ӻ����NaH���еĻ�ѧ��Ϊ���Ӽ���NaH��H2O��Ӧ�ų�H2����������ԭ��Ӧ��Ӧ�Ļ�ѧ����ʽΪ��NaH+H2O=NaOH+H2����
�ʴ�Ϊ�����Ӽ���NaH+H2O=NaOH+H2����
��2���䴢��ͷ����ԭ���ɱ�ʾΪMOFs��s��+nH2��g��$?_{����}^{����}$��H2��nMOFs��s������H��0��������������������С�ķ��ȷ�Ӧ��ƽ��������У���Ҫ������Ϊ���¸�ѹ��
�ʴ�Ϊ��B��
��3�����������仯ͼ����Ӧ�ϼ�������2��630+2��436=2132kJ���γɹ��ų�945+4��463=2797kJ�����Ը÷�Ӧ���ų�2797-2132=665kJ���������Ȼ�ѧ����ʽΪ��2NO��g��+2H2��g��=N2��g��+2H2O��g����H=-665kJ•moL-1��
�ʴ�Ϊ��2NO��g��+2H2��g��=N2��g��+2H2O��g����H=-665kJ•moL-1��
��4��ƽ��״̬c��H2��=c��CH4��=0.8mol/L��c��CO2��=0.2mol/L��
CO2��g��+4H2��g��?CH4��g��+2H2O��g��
��ʼ����mol/L�� 1.0 4.0 0 0
�仯����mol/L�� 0.8 3.2 0.8 1.6
ƽ������mol/L�� 0.2 0.8 0.8 1.6
��0��10min��v��H2��=$\frac{3.2mol/L}{10min}$=0.32mol/��L•min����
�ʴ�Ϊ��0.32mol/��L•min����
�ڷ�Ӧ��ƽ�ⳣ������ʽK=$\frac{c��{H}_{2}O��{c}^{2}��C{H}_{4}��}{c��C{O}_{2}��{c}^{4}��{H}_{2}��}$=$\frac{1��{6}^{2}��0.8}{0.2��0��{8}^{4}}$=25����Ϊ200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����������K��С��ƽ�����淴Ӧ�����ƶ������ԡ�H��0��
�ʴ�Ϊ��25������
���� ���⿼�����Ȼ�ѧ����ʽ�������㣬��ѧ����ʽ����ʽ����Ӧ�ã�������ԭ��Ӧ������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.4g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.1NA | |
| B�� | 1molHCl�������������0.5mol/L������������������� | |
| C�� | 22.4L��CO������1molN2�����ĵ�������� | |
| D�� | �κ������£�16gCH4��18gH2O�����е�������Ϊ10NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƶ�Cu��OH��2�ɼ�����ȩ�����ᡢ�Ҵ� | |
| B�� | ��ȥ������������ϩ������������ͨ��Cl2����Һ���� | |
| C�� | ��ȥ�Ҵ��������������������ʯ�ң����� | |
| D�� | ��ȥ���л��еı��ӣ�����Һ�м��������NaOH��Һ����ַ�Ӧ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӱ뾶A2-��C-��B2+ | B�� | ���ǵ�ԭ�Ӱ뾶C��B��A | ||
| C�� | ���ǵ�ԭ������A��B��C | D�� | ԭ��������ϵĵ�����C��A��B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca2+��K+��Cl-��NO3- | B�� | Na+��Ba2+��SO32-��ClO- | ||
| C�� | Fe2+��K+��SO42-��NO3- | D�� | Na+��Fe3+��S2-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl��HCl��H2O��NaOH | B�� | Cl2��Na2S��HCl��CO2 | ||
| C�� | HBr��CCl4��H2O��CO2 | D�� | Na2O2��H2O2��H2O��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
 ��������X�ĵ���ʽ
��������X�ĵ���ʽ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
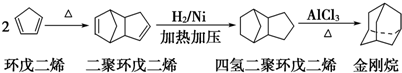
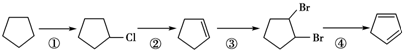
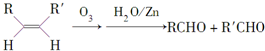 ����д�����з�Ӧ����Ľṹ��ʽ��
����д�����з�Ӧ����Ľṹ��ʽ��
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����һ�ֹ��ۻ����� | B�� | ���Ⱥ����Ӽ��ֺ����ۼ� | ||
| C�� | ����������NaOH��Һ��Ӧ | D�� | ����H2O2������ѧ����ȫ��ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com