
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
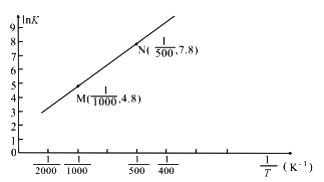
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
【答案】0.00660%c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)c3(CO2)/c3(CO)ad减小-24.9降低CO2的浓度适当降低温度
【解析】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)n(Fe)=2.24g÷56g/mol=0.04mol,由反应可知消耗CO为0.04mol×![]() =0.06mol,则10min内CO的平均反应速率为v=
=0.06mol,则10min内CO的平均反应速率为v=![]() =0.006 mol/(L·min);将混合气体通入100mL0.9mol/L的NaOH溶液中,完全反应后可得0.03molNaHCO3和0.03molNa2CO3的混合溶液,因水解溶液显碱性,且CO32-的水解程度大于HCO3-,所得溶液中离子浓度由大到小的顺序是 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ;
=0.006 mol/(L·min);将混合气体通入100mL0.9mol/L的NaOH溶液中,完全反应后可得0.03molNaHCO3和0.03molNa2CO3的混合溶液,因水解溶液显碱性,且CO32-的水解程度大于HCO3-,所得溶液中离子浓度由大到小的顺序是 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ;
(2)由Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=
2Fe(s)+3CO2(g),纯固体不能代入K的表达式中,则该反应的化学平衡常数表达式为K=![]() ;a.容器内固体质量保持不变,能说明是平衡状态,故a正确;b.因容器中气体的总物质的量不变,压强保持不变无法说明是平衡状态,故b错误;c.c(CO)=c(CO2) 无法说明是平衡状态,故c错误;d.当v正(CO)=v逆(CO2) 时能说明是平衡状态,故d正确;故答案为ad;
;a.容器内固体质量保持不变,能说明是平衡状态,故a正确;b.因容器中气体的总物质的量不变,压强保持不变无法说明是平衡状态,故b错误;c.c(CO)=c(CO2) 无法说明是平衡状态,故c错误;d.当v正(CO)=v逆(CO2) 时能说明是平衡状态,故d正确;故答案为ad;
(3)①根据图像可知,lnK随![]() 增大而增大,而温度越高,
增大而增大,而温度越高,![]() 越小,则该反应的平衡常数随温度升高而减小;
越小,则该反应的平衡常数随温度升高而减小;
②设直线与纵轴交点的纵坐标是b,则有lnK= -![]() ·
·![]() +b,将M、N两点的坐标数值代入求得b=1.8,则有4.8= -
+b,将M、N两点的坐标数值代入求得b=1.8,则有4.8= -![]() +1.8,解得△H=-24.9kJ·mol-1;
+1.8,解得△H=-24.9kJ·mol-1;
(4)此反应正方向为放热反应,可以通过 降低CO2的浓度或适当降低温度,使平衡正向移动,达到提高CO转化率的目的。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大
B.正、逆反应速率改变时,平衡一定发生移动
C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是( )
A.甲烷分子具有正四面体结构
B.甲烷化学性质比较稳定,不被任何氧化剂氧化
C.甲烷分子中具有极性键
D.甲烷分子中四个C﹣H键是完全等价的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.有些活泼金属如铝可作还原剂法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
A.3 mol B.4 mol C.5 mol D.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、M均为中学化学常见物质,它们的转化关系如下图所示(部分生成物和反应条件略去)。A与水的反应在常温下进行。下列推断不正确的是( )
A. 若A为淡黄色固体,则D可能为CO
B. 若M为可溶性铝盐,则D可能为白色沉淀,且M(D)=M(A)
C. 若D为小苏打,C转化为D的反应是CO2+H2O+CO32-=2HCO3-,则A可能为氯气
D. 若C为CO2,则A一定为化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:

已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中![]() 等于_________________
等于_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com