
| A. | 14C原子的结构示意图: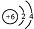 | |
| B. | H2O2的电子式: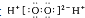 | |
| C. | NH4C的电子式: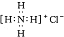 | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
分析 A.碳原子的核电荷数=核外电子总数=6,最外层含有4个电子;
B.双氧水为共价化合物,不存在阴阳离子;
C.氯化铵为离子化合物,氯离子需要标出最外层电子;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.14C原子核电荷数为核外电子总数都是6,其原子结构示意图为: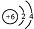 ,故A正确;
,故A正确;
B.H2O2分子为共价化合物,电子式中不存在括号和电荷,H2O2分子的电子式为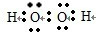 ,故B错误;
,故B错误;
C.氯化铵为离子化合物,存在铵根离子和氯离子,其正确的电子式为 ,故C错误;
,故C错误;
D.原子核内有10个中子的氧原子的质量数为18,其正确的表示方法为818O,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、原子结构示意图、元素符号等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+O2(g)?4NO(g)+6H2O (g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI (g);△H>0 | D. | C (s)+H2O (g)?CO (g)+H2 (g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>H2S | ||
| C. | Fe3+>Cl2>H2S>I2. | D. | Cl2>I2>Fe3+>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| C. | 标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L | |
| D. | 7.8g Na2O2中含有的离子总数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
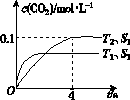

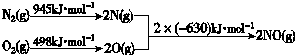
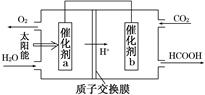
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 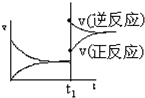 | C. |  | D. | 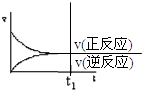 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com