
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应 | B. | 盐酸和碳酸氢钠溶液 | ||
| C. | 铜与硝酸反应 | D. | 氯化铝溶液和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023叫做阿伏加德罗常数 | |
| B. | 摩尔(mol)是国际单位制中七个基本单位之一 | |
| C. | 1mol气体的体积随压强和温度的增大而变小 | |
| D. | 气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
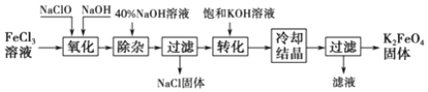
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
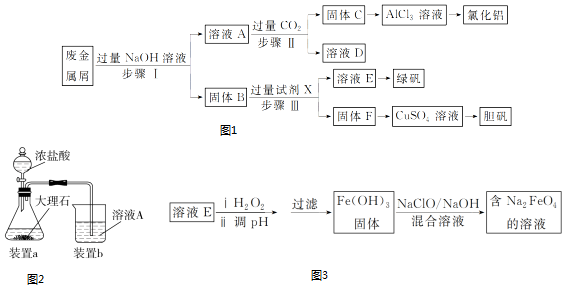
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
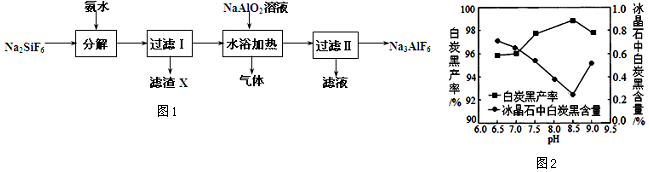
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 和盐酸; Cu(OH)2 和 CH3COOH | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 CuSO4 | |
| C. | NaHCO3 和 NaHSO4; Na2CO3 和 NaHSO4 | |
| D. | NaHCO3(过量) 和 Ca(OH)2; Ca(HCO3)2 和 NaOH(过量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 | |
| D. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com