
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3— 离子中的两种组成,可以发生如图转化,下列说法正确的是( )

A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:Fe2+、NO3—、SO42—
C.在甲中滴加丁开始反应的离子方程式HCO3—+ Ba2++OH—= BaCO3↓+ H2O
D.白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一12月月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入盐酸溶液,完全反应后过滤
B.将钠投人到盛满水的烧杯中,观察钠与水反应实验现象
C.氧化铝的熔点高于铝的熔点
D.实验室配制一定浓度NaOH溶液,将称量固体溶解后马上转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省苏州市高二上学期学业模拟三化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.把NaHCO3和Na2CO3混和物6.85 g溶于水制成100 mL溶液,其中c(Na+)=1 mol·L-1,该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4 g铁粉和氧化铁的混合物中加入4.0mol/L200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况),反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42+ 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+
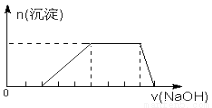
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省苏州市高二上学期学业模拟三化学试卷(解析版) 题型:选择题
一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2  2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是
A.降低温度可以加快反应速率
B.达到化学反应限度时,生成2mol NH3
C.向容器中再加入N2可以加快反应速率
D.1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省苏州市高二上学期学业模拟三化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.乙醇分子的结构式:
B.氯原子的结构示意图: 
C.过氧化氢分子的电子式: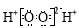
D.硫酸钠的电离方程式:Na2SO4=Na2+ + SO42?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市钦州港区高一12月月考化学卷(解析版) 题型:计算题
取50.0mL的碳酸钠和硫酸钠的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合液中碳酸钠和硫酸钠的物质的量浓度。
(2)产生气体的质量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市钦州港区高一12月月考化学卷(解析版) 题型:选择题
将50mL某未知浓度的AlCl3溶液分别加到60mL1molL-1的NaOH溶液或60mL3molL-1的NaOH溶液中,均能得到1.56gAl(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A.1molL-1 B.0.5molL-1 C.0.6molL-1 D.0.4molL-1
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三上学期一诊化学试卷(解析版) 题型:实验题
高铁酸钾(K2FeO4)是一种集氧化,吸附,絮凝于一体的新型多功能水处理剂,高铁酸盐热 稳定性差。制备方法有湿法、干法两种,其原理如下表所示:
湿法的生产工艺如下:
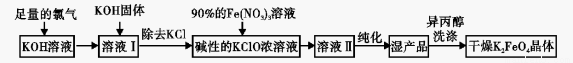
回答下列问题:
(1)K2FeO4 中Fe的化合价 ;实验室干法制备中选用的仪器是
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时KOH与Cl2反应生成的是KClO3,写出在温度较高时KOH与Cl2反应的化学方程式
___________________;
(3)在溶液 I 中加入KOH 固体的目的是
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
① Fe3++3OH-═Fe(OH)3;② 。
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有 。
(6)如何判断 K2FeO4 晶体已经洗涤干净 。
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
____FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ ( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com