
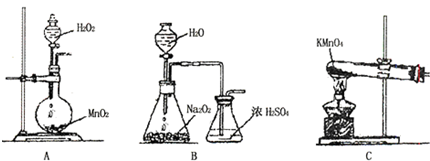
分析 Ⅰ、(1)评价实验方案要从反应的可操作性,生成物的性质,环保节能等方面分析.由于硝酸与铜直接反应时会生成有毒的氮氧化物,第一个方案环保并且使用的硫酸量较小进行分析;
(2)实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,分析装置可知,利用分液漏斗控制加入过氧化氢的量能达到要求;
Ⅱ、(2)依据物质的颜色结合假设1和假设2解答;硫酸与氧化铜反应生成硫酸铜,硫酸铜溶液呈蓝色;
三价铁离子遇到KSCN显血红色;铁粉与铜离子反应置换出铜;如果假设2成立,则加入硫酸后得到的溶液中含有三价铁离子,加入氨水后生成氢氧化铁红褐色沉淀;如果假设3成立则加入硫酸后溶液中既含有三价铁离子还含有铜离子,加入足量氨水反应生成氢氧化铁红褐色沉淀;铜离子与氨水发生反应Cu2++4NH3•H2O═Cu(NH3)42++4H2O,盐酸变为深蓝色.
Ⅲ、发生的有关反应为:Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2,FeO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Fe+CO2,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,根据反应方程式判断CO2中的O原子来源于CO和金属氧化物,CO2的物质的量等于金属氧化物中氧原子的物质的量,计算出氧化物中氧元素的质量,金属氧化物的质量等于金属的质量加氧化物中氧元素的质量.
解答 解:Ⅰ、(1)甲方案中放出的有毒气体氮氧化物会造成对空气的污染,因此,从保护环境的角度来看,甲方案不合理;乙方案铜和氧气加热生成氧化铜,氧化铜和硝酸反应产生硝酸铜和水,因此反应过程中没有污染物,且原料的利用率高;
故答案为:乙;
(2)实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,分析装置可知,利用分液漏斗控制加入过氧化氢的量能达到要求,装置B中生成的氧气通过浓硫酸可以干燥氧气,同时观察气体气泡冒出的速率控制生成氧气的速率,所以选择B装置;
故答案为:B;
Ⅱ、(2)该物质是黑色固体,也可能既含有CuO又含有Fe3O4黑色粉末,或是CuO和Fe3O4的混合物;
硫酸与氧化铜发生反应:CuO+H2SO4=CuSO4+H2O,硫酸铜溶液显蓝色,若假设1成立,实验现象为:溶液显蓝色,三价铁离子与KSCN试剂络合成红色络合物,所以如果所得溶液显血红色,证明加入硫酸后生成了三价铁离子,说明黑色物质中含有Fe3O4,所以假设2或3都有可能,铁粉与铜离子发生反应:2Cu2++Fe=3Fe2++Cu,所以如果产生红色物质,证明溶液中存在铜离子,则黑色固体中含有CuO,故假设3正确;
如果假设2成立,则加入硫酸后得到的溶液中含有三价铁离子,加入氨水后生成氢氧化铁红褐色沉淀;如果假设3成立则加入硫酸后溶液中既含有三价铁离子还含有铜离子,加入足量氨水反应生成氢氧化铁红褐色沉淀;铜离子与氨水发生反应Cu2++4NH3•H2O═Cu(NH3)42++4H2O,盐酸变为深蓝色,
故答案为:所得溶液显血红色,证明加入硫酸后生成了三价铁离子,说明黑色物质中含有Fe3O4,所以假设2或3都有可能;有红色固体析出;红褐色沉淀同时溶液呈无色;红褐色沉淀,同时溶液呈深蓝色;
Ⅲ、发生的有关反应为:Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2,FeO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Fe+CO2,CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,根据反应方程式判断CO2中的O原子来源于CO和金属氧化物,CO2的物质的量等于金属氧化物中氧原子的物质的量,计算出氧化物中氧元素的质量,金属氧化物的质量等于金属的质量加氧化物中氧元素的质量,生成的CO2为$\frac{5.00g}{100g/mol}$=0.05mol,从反应方程式可以看出,CO2中的O原子来源于CO和金属氧化物,
则氧化物中氧元素的物质的量n(O)=0.05mol,m(O)=0.05mol×16g/mol=0.8g,
所以金属氧化物的质量为2.86g+0.8g=3.66g;
故答案为:3.66g.
点评 本题考查了物质成分探究实验,题目涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,题目难度较大,分析一个反应的可行性要从多方面分析,如从反应的可行性,环保安全,操作简便,经济节能方面考虑.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素的氢化物中只有极性键没有非极性键 | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 三种元素的气态最简单氢化物中Z的氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com