
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是
A.Fe(OH)3胶体 B.盐酸
C.NaCl溶液 D.CuSO4溶液
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组欲制取SO2,并探究SO2与FeCl3溶液的反应。在图中选用必要装置完成实验。

(1)所选装置按气流方向的连接顺序为_________(填仪器接口的字母编号)。
(2)装置A中盛放浓硫酸和铜片的仪器名称为________,发生反应的化学方程式为______。
(3)欲配制装置C中100mL1mol/LFeCl3溶液,需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_______;所配溶液需用盐酸酸化,请结合离子方程式解释原因: _______ 。
(4)实验过程中观察到装置C中的实验现象为溶液由棕黄色变成红棕色,最终变成浅绿色。甲同学认为红棕色的出现,可能是产生了Fe(OH)3胶体,再混合其他颜色导致;乙同学查阅资料发现Fe(HSO3)2+为红棕色,且具有较强的还原性,认为红棕色是Fe(HSO3)2+所引起。你认为____(填“甲”或“乙”)同学分析较为合理,原因为__________,验证两位同学结论的方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中下列做法与盐的水解有关的是
A. 用硫酸铜溶液对游泳池中的水消毒
B. 用白醋除去菜刀上的铁锈
C. 用热的苏打溶液除去餐具上的油渍
D. 用石英砂过滤器除去自来水中少量的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照金属单质、混合物、氧化物的顺序排列的是 ( )
A. 水银、石灰石、过氧化氢 B. 氮气、空气、二氧化碳
C. 镁、海水、氧化钠 D. 铁、氢氧化钙、氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为____、_______。
(2)写出A的同分异构体的结构简式:_______。
(3)写出下列反应的化学方程式和反应类型。
反应①:__________,反应类型:_____________;
反应②:___________;反应类型: _____________;
反应③:_____________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试剂a名称为_______,其作用是______________。用化学方程式表示试剂a参与的化学反应:______________。
②实验结束后从混合物中分离出D的方法为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出了一种新材料,其工作原理如图所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化,从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN6]3均为无色透明,LiWO3和Fe4[Fe(CN6]3均有颜色。下列说法正确的是( )
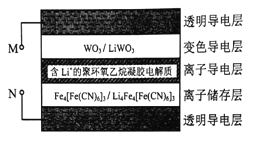
A. 当M外接电源正极时,该材料颜色变深使光的透过率降低
B. 该材料在使用较长时间后,离子导电层中Li+的量变小
C. 当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移
D. 当N外接电源正极时,离子储存层的电极反应式为:Fe4[Fe(CN6]3+4Li++4eˉ= Li4Fe4[Fe(CN6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是短周期周期表的一部分①~⑨是元素周期表的部分元素。

请回答下列问题:
(1) ③、⑤、⑥对应的原子半径最大的是_____(写元素名称)
(2)元素⑤和⑧形成的化合物的电子式是_____,该化合物溶于水被破杯的化学键类型为_______。
(3)元素⑥和⑨的最高价氧化物对应的水化物发生反应的离子方程式是________。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一稗常见的氧化剂,已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,写出A与B反应的化学方程式:______________。
(5)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

①溶液c的作用是____________。
②溶液b是(填化学式)_____。写出溶液b中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com