
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
己知:①Mn(s)+O2(g)=MnO2(s)△Hl
②S(s)+O2(g)=SO2(g)△H2
③Mn(s)+S(s)+2O2(g)=MnSO4(s)△H3
则下列表述正确的是
A.△H2>0
B.△H3>△H1
C.Mn+SO2==MnO2+S△H=△H2-△H1
D.MnO2(s)+ SO2(g)==MnSO4(s)△H=△H3-△H2-△H1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 1mol由Na2O和Na2O2组成的混合物中,含有的离子数为3NA
B. 1L1mol·L-1饱和氯化铁溶液滴入沸水中完全反应生成氢氧化铁胶粒数为NA
C. 1L 12mol•L-1浓盐酸和足量MnO2在加热条件下充分反应,生成的气体的分子数为3NA
D. 等物质的量的H2O和CO2所含原子数均为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:填空题
(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)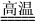 Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A. Z2Y B. X2Y2 C. Z2Y2 D. ZYX
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:简答题
某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:
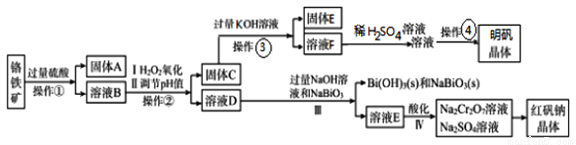
己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II目的是___________。
(2)实验室中操作④的名称为_______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3]=3×10-33。当pH=5.6时Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________(杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________(结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式_________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:选择题
在下列各溶液中,离子一定能大量共存的是( )
A. 室温下,pH=1 的溶液中:Na+、Fe3+、NO3-、SO42-
B. 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
C. 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3-
D. 在NaAlO2 溶液中:K+、Na+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:简答题
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为________;化合物ABD的结构式为______,其中B原子的杂化方式为________。
<span style="font-size: 15px; font-family: "宋体";"><span contenteditable="true">(3)</span></span>D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的 =_________;乙溶液中所含离子的物质的量浓度由大到小的顺序是_______________________________。
=_________;乙溶液中所含离子的物质的量浓度由大到小的顺序是_______________________________。
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为______________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是_________________。
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
下列关于氯的说法正确的是
A. C12化学性质活泼,在化学反应中只能得到电子
B. 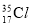 、
、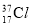 互为同位素,有不同的化学性质
互为同位素,有不同的化学性质
C. 实验室制Cl2可用排饱和食盐水集气法收集
D. 1.12L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com