
反应A(s)+B(g)⇌c(g)在密闭容器中进行,下列情况不能使反应速率加快的是( )
|
| A. | 升高温度 | B. | 增加A的物质的量 |
|
| C. | 使用催化剂 | D. | 缩小容器体积使压强增大 |
考点:
化学反应速率的影响因素.
分析:
该反应是一个反应前后气体体积不变的可逆反应,温度、浓度、催化剂、压强都影响该反应速率,据此分析解答.
解答:
解:A.无论该反应是吸热反应还是放热反应,升高温度,活化分子百分数增大,所以反应速率加快,故A不选;
B.A是固体,增加A的物质的量,A的浓度不变,则不改变反应速率,故B选;
C.使用催化剂,活化分子百分数增大,所以反应速率加快,故C不选;
D.缩小容器体积,单位体积内活化分子浓度增大,反应速率加快,故D不选;
故选B.
点评:
本题考查化学反应速率影响因素,浓度、温度、催化剂等都影响反应速率,注意浓度、压强对反应速率影响适用范围,知道反应速率增大原因,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:正确的操作顺序是( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
|
| A. | ③②①⑤④ | B. | ①②③⑤④ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列类比分析结果正确的是( )
A.Fe3O4根据化合价规律可表示为FeO·Fe2O3,则Pb3O4也可表示为PbO·Pb2O3
B.CaC2能水解:CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑,则Al4C3也能水解:
Al4C3 + 12H2O = 4A1(OH)3↓+ 3CH4↑
C.Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3
D.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间
B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L
C.0.2 mol·L-1 Na2S溶液中含有的S2-数目小于0.2NA
D.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。

(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、
。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有烧杯、玻璃棒、量筒、 、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2的催化氧化反应(2SO2+O2⇌2SO3)是一个放热的反应.如果反应在密闭容器中进行,下列有关说法中正确的是( )
|
| A. | 因为反应放热,所以升高温度会使反应速率减慢 |
|
| B. | 通过调控反应条件,SO2可以100%地转化为SO3 |
|
| C. | 当SO2与SO3的浓度相等时,反应达到平衡 |
|
| D. | 使用催化剂的目的是加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
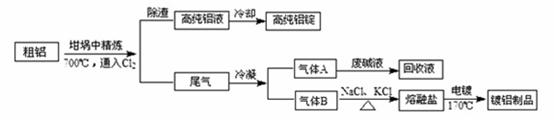
(注 :NaCl熔点为801℃;AlCl3在181℃升华)
:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和② 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为 。
(4)镀铝电解池中,金属铝为 极,熔融盐电镀中铝元素和氯元素主要以AlCl4― 和Al2Cl7―形式存在,铝电镀的主要电极反应式为 。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________部分发生反应,在______部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_______。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_______(填“前”或“后”)加入,原因是_____________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是_________。从环保和经济角度考虑,上述尾气经处理可用作________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com