
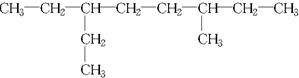
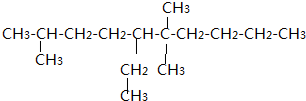 .
. .
. 分析 烷烃的命名原则:碳链最长称某烷,靠近支链把号编,简单在前同相并,其间应划一短线:
1、碳链最长称某烷:选定分子里最长的碳链做主链,并按主链上碳原子数目称为“某烷“;
2、靠近支链把号编:把主链里离支链较近的一端作为起点,用1、2、3…等数字给主链的各碳原子编号定位以确定支链的位置;
3、简单在前同相并,其间应划一短线:把支链作为取代基,把取代基的名称写在烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃主链上的位置,而且简单的取代基要写在复杂的取代基前面,如果有相同的取代基,则要合并起来用二、三等数字表示,但是表示相同的取代基位置的阿拉伯数字要用逗号隔开,并在号数后面连一短线,中间用“-“隔开.
解答 解:(1)最长碳链含有8个C,为辛烷,3号C上一个甲基,6号C上一个乙基,系统法命名为3-甲基-6-乙基辛烷,
故答案为:3-甲基-6-乙基辛烷;
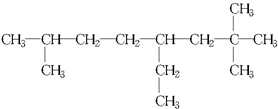
(2)最长碳链含有8个C,为辛烷,2号C上两个甲基,7号C上一个甲基,4号C上一个乙基,系统法命名为2,2,7-三甲基-4-乙基辛烷,
故答案为:2,2,7-三甲基-4-乙基辛烷;
(3)写出10个C的碳链,从一端依次编号1-10,在2号C上连接一个甲基,6号C上连接两个甲基,5号C上连接一个乙基,最后补齐H,得到结构简式为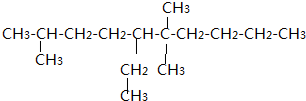
故答案为: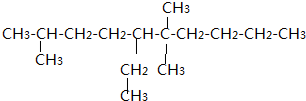 ;
;
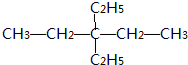
(4)写出5个C的碳链,从一端依次编号1-5,在3号C上连接两个乙基,最后补齐H,得到结构简式为 ,
,
故答案为: .
.
点评 本题考查了有机物的命名,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,解题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可.


科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 4 | C. | 2 | D. | 256 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 5:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Z>Y>W | |
| C. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可以与酸性高锰酸钾溶液反应,因此可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| B. | 溴乙烷可以通过乙烯与溴化氢加成得到,也可以通过乙烷与溴发生取代反应制备 | |
| C. | 区分甲苯和苯可以使用酸性高锰酸钾溶液,也可以用溴水 | |
| D. | 鉴别己烯中是否混有少量甲苯,正确的实验方法是可以加足量溴水,然后再加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).
在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com