
| A、用物质A表示的反应速率为1.2 mol/(L?s) |
| B、2 s时物质A的转化率为30% |
| C、用物质B表示的反应速率为0.6 mol/(L?s) |
| D、2 s时物质B的浓度为0.6 mol/L |
| △C |
| △t |
| △C |
| △t |
| n |
| V |
| 1.2-0 |
| 2 |
| 1.2mol |
| 4mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 2-0.6 |
| 1 |


科目:高中化学 来源: 题型:
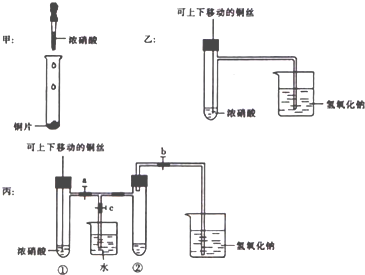
查看答案和解析>>
科目:高中化学 来源: 题型:
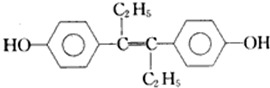
| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、该分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、标况下,1mol该有机物与足量金属钠反应可以放出22.4L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH溶液和AlCl3溶液 |
| B、Na2CO3溶液和盐酸 |
| C、NaHCO3溶液和NaOH溶液 |
| D、盐酸和NaAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com