
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2g)+3Y2g)2XY3g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | QQ>0) |
下列叙述不正确的是 )。
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.若容器①体积改为1.0 L,则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=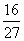
解析 由X2g)+3Y2g)2XY3g) ΔH=-92.6 kJ·mol-1可知3 mol Y2完全反应时,放出热量为92.6 kJ。发生反应的物质越多,放出的热量就越多。A项,①中达到平衡时,反应放热46.3 kJ。所以Y2的转化率为46.3 kJ÷92.6 kJ )×100%=50%,正确;B项,②中假如0.4 mol的XY3不是起始加入的,而是由X2、Y2反应生成的,则相当于起始投入量为X2=1 mol;Y2=3 mol。与①相同,则为等效平衡。根据A的分析可知平衡时Y2=1.5mol,转化量为2.4-1.5=0.9 mol,所以放出热量Q=0.9÷3)×92.6 kJ=27.78 kJ。正确;C项,若容器①体积改为1.0 L,则相当于给容器增大压强,由于该反应的正反应是气体体积减小的反应。根据平衡移动原理:
增大压强,化学平衡向气体体积减小的方向。所以达平衡时放出的热量大于46.3 kJ。正确;D项,容器①、②中反应是在相同温度下的同一个平衡状态,所以平衡常数相等,K=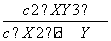 =
=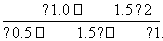 =
=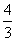 。错误。
。错误。
答案 D


科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是(双选)( )
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.将SO2和Cl2按等物质的量比通入品红溶液中,品红溶液不褪色
C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1
D.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:
X(g)+Y(g) 2Z(g)△H<O。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡.与原平衡的比较,正确的是 ( )
2Z(g)△H<O。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡.与原平衡的比较,正确的是 ( )
|
| 新平衡和原平衡比较 | |||
| A | 升高温度 | X的体积分数变大 | ||
| B | 增大压强 | Z的浓度不变 | ||
| C | 减小压强 | Y的体积分数变大 | ||
| D | 充入一定量Z | X的体积分数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是反应Ag)+3Bg)2Cg) ΔH=-a kJ·mol-1在反应过程中的能量变化关系图,回答下列问题。
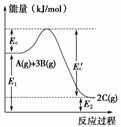
1)正反应是________填“放”或“吸”)热反应,Ec表示的含义是________;Ec′表示的含义是______;a=______。
2)由示意图知,反应物的总能量________填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能________填“>”、“<”或“=”)生成物的总键能。
3)将1 mol A、3 mol B混合置于密闭容器中,能量变化的范围是________,当达到平衡时能量的实际变化为0.7 a 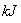 时,B的转化率为________。
时,B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是1 mol NO2g)和1 mol COg)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________填“增大”、“减小”或“不变”,下同),ΔH________。
请写出NO2和CO反应的热化学方程式:
____________________________________________________。
2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OHg)+H2Og)===CO2g)+3H2g)
ΔH=+49.0 kJ·mol-1
②CH3OHg)+1/2O2g)===CO2g)+2H2g)
ΔH=-192.9 kJ·mol-1。
又知③H2Og)===H2Ol) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)在潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

①A是制取CO2的装置。写出A中发生反应的化学方程式:____________________________________________________。
②B中盛有饱和NaHCO3溶液,其作用是____________________________________________________。
③写出过氧化钠与二氧化碳反应的化学方程式____________________________________________________
____________________________________________________。
④D中盛放的试剂是________,其目的是____________________________________________________。
⑤试管F中收集满气体后,下一步实验操作是____________________________________________________
____________________________________________________。
(2)①某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?________,简要说明理由:
____________________________________________________。
②该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
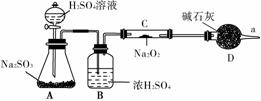
装置B的作用是____________________________________________________,
D的作用是____________________________________________________。
③为确认反应产物,该同学设计了以下实验步骤,你认为合理的操作顺序是________(选填序号)。
A.用带火星的细木条靠近干燥管口a,观察细木条是否复燃
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
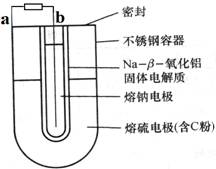
常用的电池是一个液体电解质将两个固体电极隔开。而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过。下列有关说法不正确的是
A.a为电池的正极
B.充电时b接电源的正极
C.正极反应为:nS8+16ne-=8Sn2-
D.Na+可以穿过固体电解质和硫反应从而传递电流
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液的叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液一定为中性
B.在Na2S溶液中:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO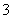 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com