
【题目】兰州地区进入秋冬季节后,经常早晨有雾。从物质的分类来看雾属于胶体,他区别于溶液等其他分散系的本质特征是
A. 胶体有丁达尔效应 B. 胶体是混合物
C. 胶体的粒子直径在1—100nm之间 D. 胶体的分散剂为气体
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( ) 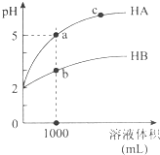
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 ===Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为____________________(说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________②__________
③_________④__________
c. ⑤的作用为_______________,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示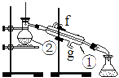
(1)写出下列仪器的名称:①②
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是 , 将仪器补充完整后进行的实验操作的名称是;②的进水口是 (填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.②静置分层后,旋开活塞,用烧杯接收下层液体
(4)这样做的目的是
(5)下层流出的是溶液,上层液体从得到(填“上口”或“下口”)
(6)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是
A.不与碘反应
B.碘在其中的溶解度大于在水中的溶解度
C.该萃取剂与水不互溶且密度不同
D.可以选用CCl4 , 酒精灯做萃取剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不可以用于实验室制取氨气的方法是
A.在浓氨水中加入固体氢氧化钠并加热
B.加热分解氯化铵晶体
C.在浓氨水中加入固体氧化钙并加热
D.加热氯化铵和消石灰的固体混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,可以用铁或铝制的容器贮存浓硫酸,下列叙述中,错误的是
A.浓硫酸具有强还原性
B.贮存浓硫酸的容器要密封,因为浓硫酸容易吸收空气中的水蒸气
C.浓硫酸可以使硫酸铜晶体由蓝色变为白色
D.常温下,浓硫酸可以使铁或铝钝化,生成一层致密的氧化膜,阻止反应继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
【答案】 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
CuSO4+2H2O+SO2↑ 吸收过量的SO2,防止污染环境 SO2+2OH- = SO32-+H2O b 溶液变红色 SO2水溶液显酸性 溶液褪色 漂白性 溶液变浑浊 氧化性 氯水褪色 还原性
【解析】(1)利用铜和浓硫酸制取SO2,选择固体与液体反应且需加热装置,故发生装置还需选用的仪器是酒精灯;Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
CuSO4+2H2O+SO2↑;(2)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH- = SO32-+H2O;(3)SO2易溶于水,密度比空气大,选用图乙收集SO2气体,气体从b口进;(4)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体;因二氧化硫具有漂白性,则②中的品红溶液褪色;
③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性;
④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,该反应为:SO2+Cl2+2H2O═2HCl+H2SO4,实验现象为氯水褪色,二氧化硫中S元素的化合价升高被氧化,说明二氧化硫具有还原性,故答案为:
装置 | 实验现象 | 体现SO2的性质 |
① | 溶液变红色 | 二氧化硫水溶液显酸性 |
② | 溶液褪色 | 漂白性 |
③ | 溶液变浑浊 | 氧化性 |
④ | 氯水褪色 | 还原性 |
点睛:本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法。综合性较强的为(4)①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③中二氧化硫与硫化氢发生氧化还原反应生成单质S;④中二氧化硫与氯水发生氧化还原反应生成硫酸和HCl,据此进行解答。
【题型】实验题
【结束】
28
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。

①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。
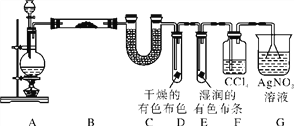
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________。
(2)①装置B中盛放的试剂名称为_______,作用是___________,现象是___________。
②装置D和E中出现的不同现象说明的问题是_______________________________。
③装置F的作用是____________________。
④写出装置G中发生反应的离子方程式:__________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应加入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是( )
①N2→NO2②S→SO2 ③NH3→NO④NO→HNO3⑤CuSO4→Cu(NO3)2⑥SiO2→H2SiO3 .
A.①⑥
B.④⑤
C.①④
D.⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com