


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 |
| B、除去氧气中少量氮气:使气体通过炽热的铜粉 |
| C、除去石英中少量碳酸钙:用稀盐酸溶解后过滤 |
| D、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
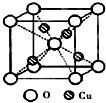 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
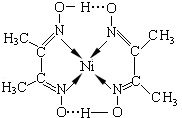
查看答案和解析>>
科目:高中化学 来源: 题型:
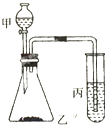 某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:
某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com