
分析 (1)a.不是所有的试剂都不能放回原瓶,如金属钠,取用后必须放回原瓶;
b.滴定管、容量瓶、分液漏斗在使用时需要检查是否漏液,防止液体漏出;
c.灼烧固体时应在坩埚中进行;
d.检验亚硫酸钠是否被氧化,不能选择硝酸钡和盐酸;
e.无水酒精你能不能作碘的萃取剂;
(2)①加入足量氯水后溶液变为橙色,说明有溴单质生成,原溶液中存在Br-;且产生气泡,因为氯水呈酸性,与氯水反应产生气体的离子应是CO32-,而不是亚硫酸根离子,因为氯水与亚硫酸根离子发生氧化还原反应生成硫酸根离子;因为含有碳酸根离子,所以A13+、Mg2+不存在,则阳离子只能是Na+;
②加入氯化钡溶液产生不溶于盐酸的白色沉淀,则①所得的溶液中一定含有硫酸根离子,说明原溶液中存在SO32-,被氯水氧化为硫酸根离子,与钡离子反应生成BaSO4白色沉淀;
③说明溶液中不存在I-,其余离子不能确定.
解答 解:(1)a.不是所有的试剂都不能放回原瓶,如金属钠,取用后必须放回原瓶,故a错误;
b.滴定管、容量瓶、分液漏斗在使用时需要检查是否漏液,防止液体漏出,故b正确;
c.灼烧固体时应在坩埚中进行,故c错误;
d.检验亚硫酸钠是否被氧化,不能选择硝酸钡和盐酸,因为硝酸钡与盐酸混合,相当于溶液中存在硝酸,则会氧化亚硫酸根离子为硫酸根离子,无法检验原固体是否被氧化,故d错误;
e.无水酒精你能不能作碘的萃取剂,因为酒精与水互溶,故e错误,
故答案为:acde;
(2)①加入足量氯水后溶液变为橙色,说明有溴单质生成,原溶液中存在Br-;且产生气泡,因为氯水呈酸性,与氯水反应产生气体的离子应是CO32-,而不是亚硫酸根离子,因为氯水与亚硫酸根离子发生氧化还原反应生成硫酸根离子;因为含有碳酸根离子,所以A13+、Mg2+不存在,则阳离子只能是Na+;
②加入氯化钡溶液产生不溶于盐酸的白色沉淀,则①所得的溶液中一定含有硫酸根离子,说明原溶液中存在SO32-,被氯水氧化为硫酸根离子,与钡离子反应生成BaSO4白色沉淀;
③说明溶液中不存在I-,其余离子不能确定.所以一定存在的离子是CO32-、SO32-、Br-、Na+;在②中产生的自色沉淀是BaSO4.
故答案为:CO32-、SO32-、Br-、Na+;BaSO4.
点评 本题考查化学实验方案的评价以及离子检验等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
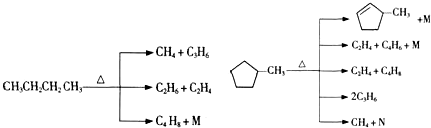
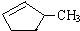 的说法正确的是A.
的说法正确的是A.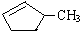 和
和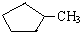
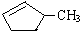 和
和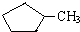 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 液氨作为清洁能源的反应原理是:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com