
【题目】常温下,向10mL1 molL-1HCl溶液中滴加1 molL-1CH3COONa溶液,所得混合液的pH 与加入CH3COONa溶液的体积(V)的变化如图所示。下列说祛错误的是
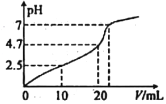
A. 常温下,CH3COOH 的电离常数Ka≈2.0×10-5
B. 随着V的增加,混合液中水的电离程度在不断增加
C. 当V=20 mL时,混合液中c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
D. 当混合液的pH=7时,混合液中c(Cl-)=c(CH3COOH)
【答案】C
【解析】向10mL1 molL-1HCl溶液中滴加10mL 1 molL-1CH3COONa溶液,溶液变为0.5molL-1CH3COOH 和NaCl,此时PH=2.5,常温下,CH3COOH的电离常数Ka≈![]() 2.0×10-5,故A正确;醋酸根离子水解促进水电离,醋酸钠浓度越大,水电离程度越大,故B正确;当V=20mL时,溶液中含有等浓度的CH3COOH、NaCl、CH3COONa,溶液呈酸性,说明醋酸电离大于醋酸钠水解,所以混合液中c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故C错误;当混合液的pH=7时,说明醋酸的电离与醋酸钠水解相互抵消,所以混合液中c(Cl-)=c(CH3COOH),故D正确。
2.0×10-5,故A正确;醋酸根离子水解促进水电离,醋酸钠浓度越大,水电离程度越大,故B正确;当V=20mL时,溶液中含有等浓度的CH3COOH、NaCl、CH3COONa,溶液呈酸性,说明醋酸电离大于醋酸钠水解,所以混合液中c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故C错误;当混合液的pH=7时,说明醋酸的电离与醋酸钠水解相互抵消,所以混合液中c(Cl-)=c(CH3COOH),故D正确。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。
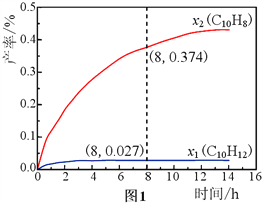

①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
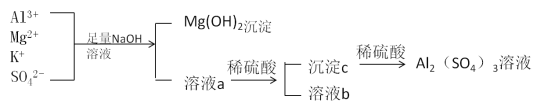
请回答下列问题:
(1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。
(2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。
(3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物胃复安:

已知: ![]()
请回答:
(1)化合物A的结构简式_______。
(2)下列说法不正确的是_______。
A.化合物B能发生加成反应 B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性 D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D 的合成路线(用流程图表示,试剂任选) _______。
(4)写出D+EF的化学方程式_______。
(5)写出化合物E可能的同分异构体的结构简式_______,须同时符合:①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N一H键存在;②分子中没有同一个碳上连两个( )氮的结构。
)氮的结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C表示质子数为6、中子数为8的核素
C表示质子数为6、中子数为8的核素
B. 甲醇(CH3OH)和甘油(CH2OHCHOHCH2OH)互为同系物
C. C5H12的同分异构体有3种,其沸点各不相同
D. CH3CH2CH2CH(CH3)2的名称是2甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
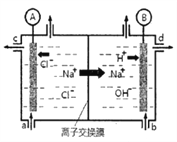
完成下列填空:
①离子交换膜的作用为:____________________。
②写出电解饱和食盐水的离子方程式_________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
⑵电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O![]() 的工业废水的处理,下列说法正确的是(____)
的工业废水的处理,下列说法正确的是(____)
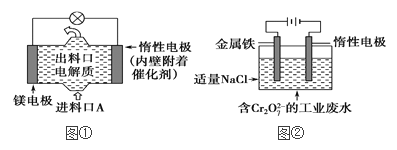
A.图②中Cr2O![]() 离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀
⑶观察下列装置,回答下列问题:
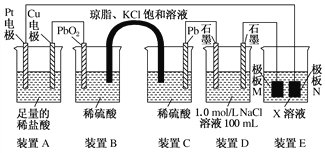
①装置B中PbO2上发生的电极反应方程式为_____________________________________。
②装置A中总反应的离子方程式为_____________________________________________。
③当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下,不考虑气体的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com