
 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO2 | H2 | H2 | C2H5OH | |||
| 1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
| 2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
| 3 | 900 | 4 | 8.8 | C | d | t |
分析 (1)①实验1中6min到达平衡,平衡时消耗氢气为(6.8-2)mol=4.8mol,再根据v=$\frac{△c}{△t}$计算v(H2);
②900℃平衡时氢气为2mol、乙醇为0.4mol,则:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
起始量(mol):2 4.4 0 0
变化量(mol):0.8 2.4 0.4 1.2
平衡量(mol):1.2 2 0.4 1.2
再根据K=$\frac{c({C}_{2}{H}_{5}OH)×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$计算化学平衡常数;第3组等效为第2组平衡的基础上增大压强,平衡正向移动;
(2)①n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则反应生成碳酸钾;
②根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾;
③当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=2}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.5}\\{y=1}\end{array}\right.$,溶液中碳酸根、碳酸氢根离子水解,溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子.
解答 解:(1)①实验1中6min到达平衡,平衡时消耗氢气为(6.8-2)mol=4.8mol,v(H2)=$\frac{\frac{4.8mol}{2L}}{6min}$=0.4mol/(L.min),故答案为:0.4mol/(L.min);
②900℃平衡时氢气为2mol、乙醇为0.4mol,则:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
起始量(mol):2 4.4 0 0
变化量(mol):0.8 2.4 0.4 1.2
平衡量(mol):1.2 2 0.4 1.2
900℃平衡常数K=$\frac{c({C}_{2}{H}_{5}OH)×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$=$\frac{0.2×0.{6}^{3}}{0.{6}^{2}×{1}^{6}}$=0.12;
第3组等效为第2组平衡的基础上增大压强,平衡正向移动,CO2的转化率增大,
故答案为:0.12;增大;
(2)①n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则反应生成碳酸钾,电池总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
②根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾,负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
③当V=33.6L时,n(CO2)=1.5mol,设碳酸钾的物质的量为x、碳酸氢钾的物质的量为y,根据K原子、C原子守恒得$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=2}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.5}\\{y=1}\end{array}\right.$,溶液中碳酸根、碳酸氢根离子水解,溶液呈碱性,碳酸根离子水解程度大于碳酸氢根离子,所以溶液中离子浓度大小顺序为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查化学平衡计算与影响元素、原电池、离子浓度大小比较等,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 33.3% | B. | 40% | C. | 60% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
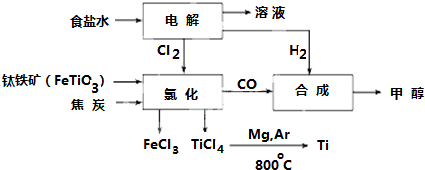
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2NH3+3CuO→3Cu+N2+3H2O | B. | 2Na+2NH3→2NaNH2+H2↑ | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(蓝色石蕊试纸先变红后褪色) | B. | 氯水(pH试纸先变红后褪色) | ||
| C. | Na2S(pH试纸变红) | D. | KI(淀粉试纸变蓝) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1molH2(g)和1mol I2(g)总能量小于2mol HI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量为2akJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com