
| A、氯化钠和金刚石的熔化 |
| B、干冰和C60的熔化 |
| C、氯化氢和氯化钾的溶解 |
| D、溴和汞的气化 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| A、在①、②中分别加入氯化铵固体,两溶液的 pH均增大 |
| B、分别将等体积的①和②加水稀释m倍和n倍后,pH仍相同,则:m>n |
| C、把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 氧气中含有6.02×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为2:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反 应:Fe3++6SO2?Fe(SO2)63+(反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL 0.2mol?L-1 的 NaCl 溶液 |
| B、100mL 0.1mol?L-1 的 NaCl 溶液 |
| C、25mL 0.2mol?L-1 的 Na2SO4 溶液 |
| D、10mL 0.5mol?L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
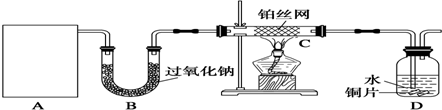

查看答案和解析>>
科目:高中化学 来源: 题型:
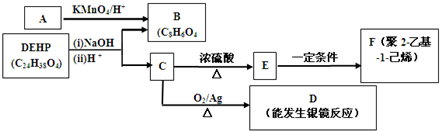
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com