
【题目】下列图像正确的是( )
A.向CaIOH)2和NaOH的混合溶液中通入CO2 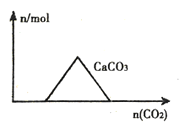
B.向1L浓度均为0.1mol/L的NaAlO2、Ba(OH)2的混合溶液中加入0.1mol/L的稀H2SO4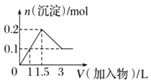
C.向1L浓度分别为0.1mol/L和0.3mol/L的AlCl3、NH4Cl的混合溶液中加入0.1mol/L的稀NaOH溶液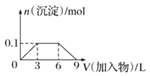
D.向氢氧化钠溶液中滴加明矾溶液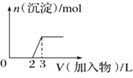
【答案】B
【解析】
A.向Ca(OH)2和NaOH的混合溶液中通入CO2,CO2先与Ca(OH)2反应,所以一开始就有碳酸钙沉淀生成,当Ca(OH)2全部反应后,再与NaOH反应,图象不符,A错误;
B.向1L浓度均为0.1mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1mol·L-1的稀H2SO4,0.1mol Ba(OH)2消耗0.1mol硫酸,0.1mol NaAlO2消耗0.05mol 硫酸,硫酸过量时氢氧化铝溶解,0.1mol氢氧化铝消耗硫酸0.15mol,与图像符合,B正确;
C.向1L浓度分别为0.1mol·L-1和0.3mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1mol·L-1的稀NaOH溶液,AlCl3与NaOH反应生成氢氧化铝沉淀,且沉淀的量为0.1mol;然后氢氧化钠与氯化铵反应生成氨水,最后氢氧化铝与氢氧化钠反应,沉淀溶解,此时氢氧化铝与氢氧化钠的物质的量比为1:1,即0.1mol氢氧化铝消耗0.1mol氢氧化钠,体积为1L,而不是3 L,C错误;
D.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,当硫酸铝钾滴加到2个单位时,生成的偏铝酸根离子也为2个单位,继续滴加硫酸铝钾,铝离子与偏铝酸根离子恰好反应生成氢氧化铝沉淀,消耗硫酸铝钾为![]() 个单位,与图象不符合,D错误;
个单位,与图象不符合,D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略)
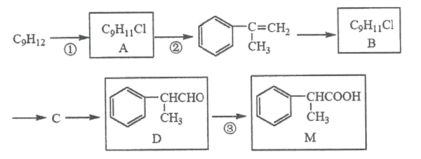
已知A与B互为同分异构体。
(1)1molD最多能与______molH2发生加成反应。
(2)反应①所需的试剂和条件是____________,反应③的反应类型是____________。
(3)反应②的化学方程式是____________。
(4)写出检验D已经完全转化为M的方法____________。
(5)写出一种符合下列要求的M的同分异构体的结构简式____________。
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图。
的合成路线流程图。
已知:![]()
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外层电子数相同。表给出了四种元素的部分信息,则下列说法正确的是
元素 | X | Y | Z | W |
原子半径/nm | 0.134 | r1 | r2 | 0.106 |
A.r1>r2>0.106
B.0.134<r1<r2
C.0.134>r1>r2
D.电子层数多的元素的原子半径一定比较大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有
① CO2、SO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
⑧ 金属元素和非金属元素形成的化合物不一定是离子化合物
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
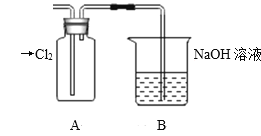
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,![]() 可以衰变为
可以衰变为![]() ,则可用来比较这两种元素金属性强弱的方法是( )
,则可用来比较这两种元素金属性强弱的方法是( )
A.比较这两种元素的单质的熔点
B.向氯化铝和氯化镁的溶液中分别滴加过量的氨水
C.将打磨过的镁带和铝片分别与试管中的热水作用,并滴入酚酞溶液
D.将打磨过的铝片和镁带分别投入氢氧化钠溶液中,Al能与![]() 溶液反应放出氢气,而Mg不能
溶液反应放出氢气,而Mg不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+2e-===Cl2↑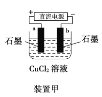
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+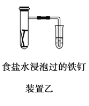
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-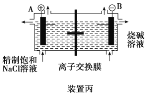
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成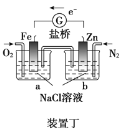
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于盐类水解反应的是
A. Na2CO3溶液:CO32- + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. NaHCO3溶液:HCO3- + H2O ![]() CO32- + H3O+
CO32- + H3O+
C. NaHS溶液:HS- + H2O ![]() H2S + OH-
H2S + OH-
D. KF溶液:F- + H2O = HF + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
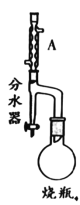
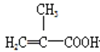
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
 +CH3OH
+CH3OH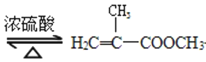 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com