
 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.| 滴定次数 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |
分析 (1)根据题中信息,标准液为碱溶液,应该选用碱式滴定管;
(2)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(3)先判断滴定数据的有效性,然后根据有效的数据计算出盐酸的浓度.
解答 解:(1)用中和滴定法测定某盐酸的物质的量浓度,说明标准液为碱溶液,应该选用碱式滴定管,A为碱式滴定管,所以选用A,
故答案为:A;
(2)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去,
故答案为:当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去;
(3)第一次滴定消耗标准液的体积为:20.41mL-0.40mL=20.01mL;
第二次滴定消耗标准液体积为:20.60mL-0.10mL=20.50mL,
第三次滴定消耗标准液体积为:23.99mL-4.00mL=19.99mL,
第二次实验无效,两次消耗的标准液的平均体积为:$\frac{20.01+19.99}{2}$mL=20.00mL,
待测液的体积20mL,根据反应关系式:NaOH~HCl,所以c待=$\frac{{c}_{标}{V}_{标}}{{V}_{待}}$=$\frac{0.125×0.02}{0.02}$=0.1250mol•L-1,
故答案为:0.1250.
点评 本题考查了酸碱中和滴定,题目难度不大,涉及了仪器的选择、待测液浓度计算、滴定数据处理等知识,侧重于考查学生的分析能力、计算能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 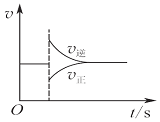 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 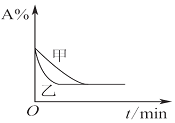 图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且甲的压强大 | |
| C. | 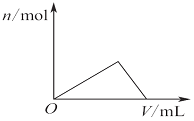 图表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 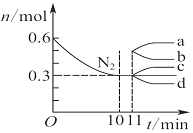 图表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
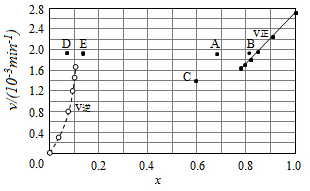 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ CO32- Cl- | B. | H+ SO42- Ba2+ | ||
| C. | K+ H+OH- | D. | Fe3+ Na+ NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com