
【题目】下列离子方程式书写正确的是
A. 可利用厨房中的食醋除去热水瓶水垢中的CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
B. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
C. 往NH4HCO3溶液中加过量的NaOH溶液并加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 金属钠和水反应:Na+H2O=Na++OH-+H2↑
科目:高中化学 来源: 题型:
【题目】已知:
(1) H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ/mol;
(2) 2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ/mol;
(3) H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ/mol;
(4) 2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
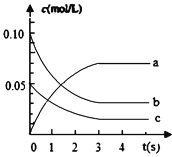
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
铝及其化合物在工农业生产生活中有着重要的用途。
(1)离子镀钛氮化铝是一种高强度的保护层,Ti基态核外电子排布式为 。
(2)AlCl3是有机反应中常用的催化剂。
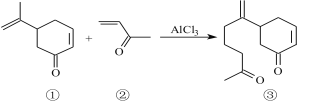
有机物①碳原子的杂化类型为 。1 mol有机物②分子中含有σ键的数目为 mol。
(3)一定条件下用Al2O3和CCl4反应制备COCl2,写出与COCl2互为等电子体的阴离子的化学式:
。
(4)双聚物Al2Cl6结构如图甲所示。在Al2Cl6中存在的相互作用有 (填字母)。
a.范德华力 b.离子键 c.共价键 d.氢键 e.配位键
(5)氮化铝(其晶胞如图乙所示) 晶体中离铝原子最近的氮原子的个数为 。
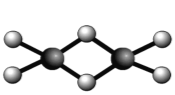
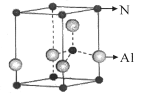
甲 乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应平衡常数表达式为K=![]() 达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
A. 反应的热化学方程式为NO2(g)+SO2(g) ![]() NO(g)(g)+SO3(g) △H>0
NO(g)(g)+SO3(g) △H>0
B. 一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C. 混合气体的平均摩尔质量保持不变,说明反应已达平衡
D. 使用合适的催化剂可使该反应的反应速率和平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质是一类在水溶液或熔融状态下能够导电的化合物。下列物质属于电解质的是
A. Cl2 B. NaOH C. C2H5OH D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:
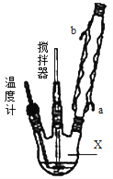

请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com