
【题目】用生产甲醇的废催化剂(主要成分为ZnO和CuO,还含有少量有机杂质等)制散CuCl和ZnO的工艺流程如下:
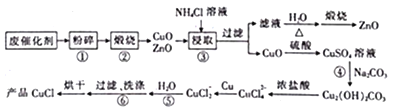
已知用NH4Cl溶液设取时.发生的主要反应如下,
ZnO(s)+2NH4Cl(aq)![]() Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
CuO(s)+2NH4Cl(aq)![]() Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
回答下列同题:
(1)预处理时,废催化剂需进行“粉碎”的主要目的是________;步骤②中“煅烧”的目的是______________。
(2)步骤④发生反应的离子方程式为______________________________。
(3)步骤⑤加H2O稀释的目的是____________________________________________。
(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是_____________________。
(5)准确称取mg产品CuCl,将其溶于稍过量的FeCl3溶液中,充分溶解后、加入适量的稀硫酸,用cmol·L-1的K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液的体积为VmL。已知滴定时Cr2O72-被还原为Cr3+,则滴定过程中发生反应的离子方程式为______________________;该反应中氧化剂与还原剂的物质的量之比为________;该产品中CuCl的质量分数为________(用含c、m、V的代数式表示)。
【答案】 提高铜和锌的浸取率 使其中的C、N、S等杂质被氧化而除去 2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑ 降低Cl-浓度,有利于平衡CuCl2-![]() CuCl+Cl-正向移动,得到更多的CuCl沉淀 取最后一次洗涤过滤液于试管中,滴加AgNO3溶液,若无白色沉淀生成,说明已洗涤干净 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1:6
CuCl+Cl-正向移动,得到更多的CuCl沉淀 取最后一次洗涤过滤液于试管中,滴加AgNO3溶液,若无白色沉淀生成,说明已洗涤干净 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1:6 ![]() ×100%
×100%
【解析】(1)预处理时,废催化剂需进行“粉碎”的主要目的是提高铜和锌的浸取率;步骤②中“煅烧”的目的是使其中的C、N、S等杂质被氧化而除去;(2)步骤④碳酸钠与硫酸铜溶液混合反应生成碱式碳酸铜和二氧化碳,发生反应的离子方程式为2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑;(3)步骤⑤加H2O稀释的目的是降低Cl-浓度,有利于平衡CuCl2-![]() CuCl+Cl-正向移动,得到更多的CuCl沉淀;(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是取最后一次洗涤过滤液于试管中,滴加AgNO3溶液,若无白色沉淀生成,说明已洗涤干净;(5) Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,滴定过程中发生反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;根据反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,氧化剂Cr2O72-与还原剂Fe2+的物质的量之比为1:6;氯化亚铜与氯化铁发生反应:Fe3++CuCl=Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,反应的关系式为
CuCl+Cl-正向移动,得到更多的CuCl沉淀;(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是取最后一次洗涤过滤液于试管中,滴加AgNO3溶液,若无白色沉淀生成,说明已洗涤干净;(5) Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,滴定过程中发生反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;根据反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,氧化剂Cr2O72-与还原剂Fe2+的物质的量之比为1:6;氯化亚铜与氯化铁发生反应:Fe3++CuCl=Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,反应的关系式为
6CuCl~6Fe2+~Cr2O72-
6 1
n cV×10-3mol
n=6cV×10-3mol
m(CuCl)=99.5g/mol×6cV×10-3mol=0.597cVg
则样品中CuCl的质量分数为![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 过氧化钠与水反应:2O22-+2H2O=O2↑+4OH-
B. NaOH溶液与氯化铵溶液共热:OH-+NH4+![]() NH3↑+H2O
NH3↑+H2O
C. 氯气与水反应:Cl2+H2O![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D. 氯化铁溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,下列有关短周期元素X、Y、Z、R的叙述正确的是
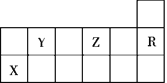
A. 热稳定性:Y的最简单气态氢化物大于Z的最简单气态氢化物
B. Z的最高价氧化物对应水化物的分子式为H2ZO4
C. X元素的单质能与所有强酸发生反应放出H2
D. R的核外电子数与OH-的核外电子总数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
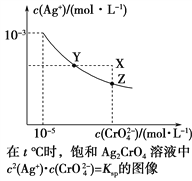
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物a、b、c的键线式如下图。下列说法正确的是

A. b和c 互为同分异构体 B. b的一氯代物(不含立体异构)有7种
C. a和b分子中所有碳原子均处于同一平面上 D. a、b和c在一定条件下均能与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是

A. V1表示HA 溶液的体积,V2表示BOH 溶液的体积
B. Ka( HA) 和Kb( BOH) 的数量级相等,均为10-6
C. y点时,c(B+)=c(A-)=c(OH-)=c(H+)
D. x、y、z 所示三点时水的电离程度:y>x=z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com