
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |


科目:高中化学 来源: 题型:
| A、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 | ||
B、室温下,将浓度为0.1mol?L?1HF溶液加水稀释,其电离平衡常数和
| ||
| C、电解精练铜时,阳极泥中常含有金属金、银、锌等 | ||
| D、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
| C、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液与足量Fe2(SO4)3溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
| B、足量NaOH溶液与NH4HS溶液反应:OH-+NH4+═NH3?H2O |
| C、向Br2水中加入少量的Na2SO3溶液:Br2+SO32-+H2O═SO42-+2H++2Br- |
| D、在氯化钙溶液中通入少量的二氧化碳:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Fe2+):c(Cu2+)=2:1 |
| C、c(Fe2+):c(Fe3+)=3:1 |
| D、c(Cl-)=6mol/L,c(Fe2+)=0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.089 | 0.074 | 0.099 |
| 主要化合价 | +1 | +2 | -2 | +7、-1 |
| A、X、Y元素的金属性:X<Y |
| B、X、Z形成的化合物中一定不含共价键 |
| C、W的最高价氧化物的水化物是一种强酸 |
| D、离子半径:X+>Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
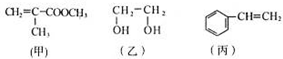 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )| A、甲物质可以在引发剂作用下生成有机高分子化合物 |
| B、1mol乙物质可与2mol钠完全反应生成1mol氢气 |
| C、丙物质能够使酸性高锰酸钾溶液退色 |
| D、甲、乙、丙三种物质都可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
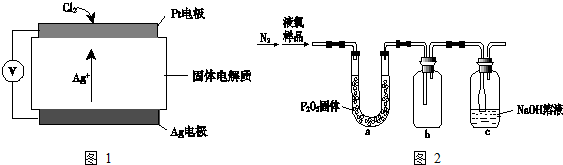
查看答案和解析>>
科目:高中化学 来源: 题型:
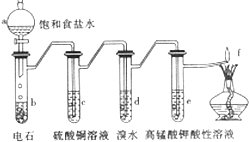 如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )
如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )| A、制备乙炔的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑ |
| B、c的作用是除去影响后续实验的杂质 |
| C、d中的有机产物与AgNO3溶液混合能产生沉淀 |
| D、e中的现象说明乙炔能被高锰酸钾酸性溶液氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com