
【题目】已知烃A的分子式为C6H12,分子中含有碳碳双键,且仅有一种类型的氢原子,在下面的转化关系中,D1、D2互为同分异构体,E1、E2互为同分异构体。

(1)反应②的化学方程式为
___________________________________________________________;
(2)C的化学名称是_____________________________;E2的结构简式是_______________________;
(3)④、⑥的反应类型依次是_________________________、__________________________
【答案】 +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O; 2,3-二甲基-1,3-丁二烯
+2NaCl+2H2O; 2,3-二甲基-1,3-丁二烯 ![]() 1,4-加成反应 取代反应
1,4-加成反应 取代反应
【解析】
烃分子式为C6H12,只含有一个碳碳双键且只有一种类型的氢原子的结构简式为![]() ;A(
;A(![]() )与氯气加成生成B(
)与氯气加成生成B( );B强碱醇溶液作用下发生消去反应生成C(
);B强碱醇溶液作用下发生消去反应生成C(![]() );C与溴的四氯化碳溶液1,2-加成生成D1(
);C与溴的四氯化碳溶液1,2-加成生成D1( ),D1强碱溶溶液作用下水解生成E1(
),D1强碱溶溶液作用下水解生成E1( );C与溴的四氯化碳溶液1,4-加成生成D2(
);C与溴的四氯化碳溶液1,4-加成生成D2(![]() );D2强碱溶溶液作用下水解生成E2(
);D2强碱溶溶液作用下水解生成E2(![]() )。
)。
(1)根据以上分析可知反应②是B( )强碱醇溶液作用下发生消去反应生成C(
)强碱醇溶液作用下发生消去反应生成C(![]() ),化学方程式为:
),化学方程式为: +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O;
+2NaCl+2H2O;
答案: +2NaOH
+2NaOH![]()
![]() +2NaCl+2H2O;
+2NaCl+2H2O;
(2)C为![]() ,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是
,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是![]() ;
;
答案:2,3-二甲基-1,3-丁二烯 ![]()
(3)反应④是二烯烃发生的1,4-加成反应,反应⑥是卤代烃的分解反应,属于取代反应;
答案:1,4-加成反应 取代反应


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式____;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为____,滴定终点观察到的现象为___;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为____(结果保留四位有效数字),若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会____(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。计算沉淀生成的溶液的pH= ___(假设Cu2+被完全沉淀,混合后溶液体积不发生变化);
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入适量30% H2O2,使其充分反应;
②_______;
③过滤;
④______;
⑤过滤、洗涤、干燥;
⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中进行下述反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) 30s内,NO增加了0.3mol,则在30s内,该反应的平均反应速率正确的是
4NO(g)+6H2O(g) 30s内,NO增加了0.3mol,则在30s内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B.V(NO )=0.08mol·L-1·s-1
C.V(H2O)=0.01mol·L-1·s-1 D.V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:

(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在上述元素中,金属性最强的是___,原子半径最大的是___(0族除外)。
(2)用电子式表示⑦和⑩形成的化合物的过程___。
(3)表中元素构成10电子微粒的分子有:___(任写2种)。
(4)⑤和⑨分别与氢原子构成的简单氢化物中沸点最高的是___。
(5)表中元素⑤和⑦可以形成一种淡黄色物质X,写出X的电子式:___,该物质所含化学键类型___,0.1molX与水反应转移电子数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示CH4+Cl2![]() CH3Cl+HCl中的相关微粒,其中错误的是
CH3Cl+HCl中的相关微粒,其中错误的是
A. 中子数为20的氯原子:![]()
B. Cl的结构示意图:![]()
C. CH4的比例模型: ![]()
D. HCl的电子式:H∶Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8组物质或粒子:
①14N和14C
②16O和18O
③氰酸铵(NH4CNO)与尿素[CO(NH2)2]
④足球烯(C60)和金刚石
⑤CH3CH2CH2CH3和CH(CH3)3
⑥CH3CH2CH3和CH3(CH2)2CH3
⑦![]() 和
和![]()
⑧
(1)互为同素异形体的是____________(填编号,下同),
(2)互为同位素的是____________,
(3)互为同系物的是____________,
(4)互为同分异构体的是____________。
Ⅱ.回答下列有关有机化学的问题:
(5)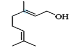 的分子式为____________,该物质所含官能团名称是____________。
的分子式为____________,该物质所含官能团名称是____________。
(6)苯与浓硫酸和浓硝酸混合加热产生硝基苯的反应方程式为____________,反应类型是____________。
(7)下列能使酸性高锰酸钾溶液褪色的是____________。
A.乙醇 B.聚乙烯 C.苯 D.甲苯 E.戊烷 F.苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na、Mg、Al活动性顺序,某课外小组同学进行了如下实验:
实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中。 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液。 3.将一小段镁带投入稀盐酸中。 4.将一小片铝投入稀盐酸中。 |
他们记录的实验现象有:
实验现象 | ①剧烈反应,迅速生成大量的气体。 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③反应不剧烈,产生无色气体。 ④有气体产生,溶液变成红色。 |
请帮助该小组同学补充下列实验报告中的内容。
(1)在下表中填写与实验步骤相对应的实验现象序号。
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)写出镁与水反应的化学方程式: _____。
(3)实验结论是: Na、Mg、Al金属性逐渐_____。
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐_____,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此_____逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com