
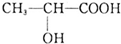 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物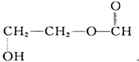 与乳酸互为同分异构体 与乳酸互为同分异构体 |
分析 该分子中含有醇羟基和羧基,具有醇和羧酸的性质,能发生取代反应、氧化反应、缩聚反应、酯化反应、中和反应等,据此分析解答.
解答 解:A.含有醇羟基和羧基,二者都能发生酯化反应,所以乳酸中能发生酯化反应的官能团有2种,故A正确;
B.只有羧基能和NaOH发生中和反应,所以1 mol乳酸可与1mol NaOH发生中和反应,故B错误;
C.醇羟基和羧基都能和钠反应生成氢气,所以1 mol乳酸与足量金属Na反应生成1 mol H2,故C正确;
D.分子式相同、结构不同的有机物互为同分异构体,所以有机物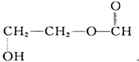 与乳酸互为同分异构体,故D正确;
与乳酸互为同分异构体,故D正确;
故选B.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查醇和羧酸的性质,易错选项是B,注意醇羟基和氢氧化钠不反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
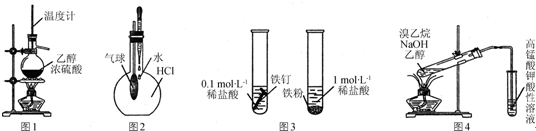
| A. | 用图1所示装置制取乙烯 | |
| B. | 用图2所示方法验证HCl气体易溶于水 | |
| C. | 用图3所示方法探究固体表面积对反应速率的影响 | |
| D. | 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>0,△H2<0 | B. | △H3>△H4 | ||
| C. | △H1=△H2+2△H3-△H5 | D. | 2△H5+△H1<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
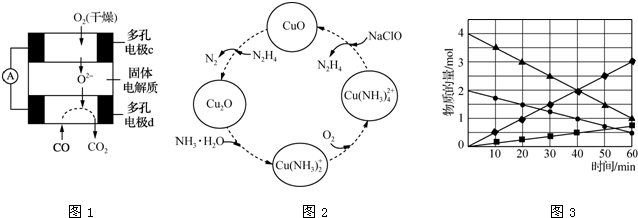
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:
W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
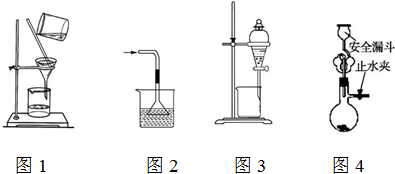
| A. | 用图1所示装置进行过滤,过滤时不断搅拌 | |
| B. | 用图2所示装置吸收NH3制氨水 | |
| C. | 用图3所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图4所示装置用石灰石与稀盐酸制取CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
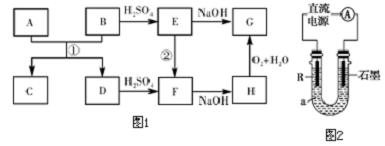
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com