
| A. | 相同温度下,硫酸溶液的导电能力应强于醋酸溶液的导电能力 | |
| B. | NaCl在电流作用下电离成Na+和Cl- | |
| C. | CuSO4溶液导电时要伴随化学变化 | |
| D. | CO2水溶液的导电能力较弱,CO2是弱电解质 |
分析 A.电解质溶液导电性与离子浓度成正比,与电荷成正比;
B.氯化钠在水分子作用下电离出阴阳离子;
C.硫酸铜溶液导电时是通过得失电子导电的;
D.CO2水溶液能导电,是因为二氧化碳和水生成的碳酸电离出阴阳离子,而不是二氧化碳电离出的阴阳离子.
解答 解:A.电解质溶液导电性与离子浓度成正比,与电荷成正比,与电解质强弱无关,强电解质溶液中离子浓度小于弱电解质溶液,则该强电解质溶液导电能力小于弱电解质,故A错误;
B.氯化钠在水分子作用下电离出阴阳离子,不需要外接电源,故B错误;
C.硫酸铜溶液导电时是通过得失电子导电的,所以一定发生化学反应,故C正确;
D.CO2水溶液能导电,是因为二氧化碳和水生成的碳酸电离出阴阳离子,而不是二氧化碳电离出的阴阳离子,所以碳酸是电解质、二氧化碳是非电解质,故D错误;
故选C.
点评 本题考查电解质的导电性,为高频考点,明确电解质溶液导电性与离子浓度关系、基本概念是解本题关键,注意电解质溶液导电性强弱与离子浓度及电荷有关,与电解质强弱无关,易错选项是D,知道电解质溶液导电性与电解质的关系,电解质不一定导电,导电的不一定是电解质.


科目:高中化学 来源: 题型:解答题
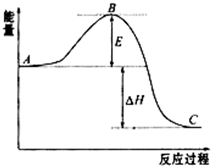 (1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol
(1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
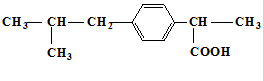 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打与烧碱溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向氯化铝溶液中加入足量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L | |
| C. | 0.3mol/L的Na2SO4溶液中含有的Na+和SO42- 的总物质的量为0.9mol | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com