

分析 (1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变.
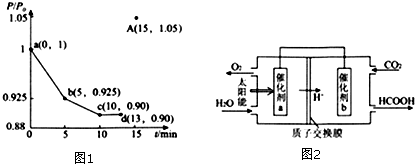
(2)①根据图示可以看出,CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0;
(3)根据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”结合反应机理来书写方程式并结合化合价判断;
(4)Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),根据溶度积常数来计算.
解答 解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:△S>0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2,故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)•c(CO32-),Ksp(CaSO4)=c(Ca2+)•c(SO42-),溶液中$\frac{c({CO}_{3}^{2-})}{c({SO}_{4}^{2-})}$=$\frac{Ksp(CaC{O}_{3})}{Ksp(CaS{O}_{4})}$.
故答案为:$\frac{Ksp(CaC{O}_{3})}{Ksp(CaS{O}_{4})}$.
点评 本题涉及反应的方向判断、盖斯定律的应用以及沉淀溶解平衡常数的计算知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,铜是负极 | B. | H+在溶液里流向锌片 | ||
| C. | 负极发生还原反应 | D. | 电子经外电路由锌流向铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的摩尔质量为1g•mol-1 | B. | 水的摩尔质量是18g | ||
| C. | 1molN2的质量为28g•mol-1 | D. | NO3-的摩尔质量是62g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点很高,可用作熔融NaOH的坩埚材料 | |
| B. | 常温下,金属铝不被空气中的氧气氧化,因而能做导线 | |
| C. | 二氧化硅属于硅酸盐材料,玻璃钢属于复合材料 | |
| D. | 生产玻璃和水泥都要用到的原料是石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com