
| X | ||
| M |
 ;
;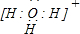 ;
;分析 W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与M的最低负化合价相同,则Z和M位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为S元素,故Z为O元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素,(4)中Z与W形成的4核离子,则W是H元素,然后结合物质结构性质解答.
解答 解:W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,由于最外层电子数不大于8,则W最外层电子数是1,其原子序数最小,为Li或H元素;X原子最外层电子数为4,Z与M的最低负化合价相同,则Z和M位于同一主族,由原子序数结合元素在周期表中的位置知,X位于第二周期,M位于第三周期,结合原子序数可知,X为C元素,M为S元素,故Z为O元素;Y的原子序数介于C、O之间,故Y为N元素;Q的原子序数最大,故Q为Cl元素,(4)中Z与W形成的4核离子,则W是H元素,
(1)X是C元素,位于第二周期第IVA族,Q是氯元素,故答案为:第二周期第IVA族;氯;
(2)X元素的最高价氧化物为二氧化碳,其电子式为 ,故答案为:
,故答案为: ;
;
(3)S、Cl同周期,原子序数依次增大,故非金属性S<Cl,元素单质之间的置换等可以证明该事实,反应方程式为H2S+Cl2=2S↓+2HCl,
故答案为:<;H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核离子为水合氢离子,其电子式为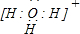 ,故答案为:
,故答案为: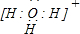 ;
;
(5)C、N可分别与O以原子个数比1:1形成化合物丙和丁分别为CO、NO,在催化剂存在条件下,丙与丁发生反应,生成单质N2和另一种化合物戊,戊为CO2,该反应的化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素的性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意X、W及元素的位置为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:解答题
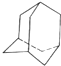 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
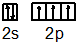 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
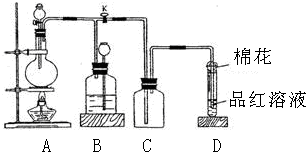
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
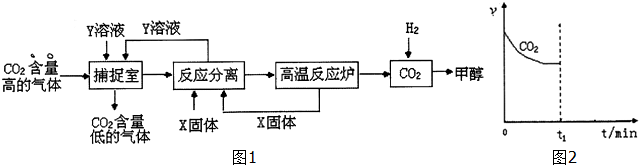
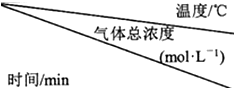 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com