
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
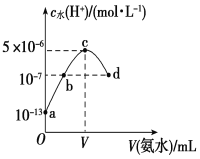
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
【答案】A
【解析】
A. c点所示溶液是硫酸铵溶液,电荷守恒式为c(H+)+c(NH4+)═2c(SO42)+c(OH),物料守恒式为c(NH4+) +c(NH3.H2O)═2c(SO42),两式相减可得:c(H+)c(OH)═c(NH3.H2O),故A正确;
B. 根据电荷守恒:c(H+)+c(NH4+)═2c(SO42)+c(OH),b点为硫酸铵和硫酸的混合溶液,呈酸性,c(OH)<c(H+),所以c(NH4+)<2c(SO42),故B错误;
C. c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,所以氨水的体积也是20ml,即V=20,故C错误;
D. 根据20mL的稀H2SO4溶液中,水电离出的氢离子浓度是1013,根据水的离子积得到硫酸电离出的氢离子浓度是0.1mol/L,稀硫酸的浓度为0.05mol/L,故D错误;
答案选AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图:
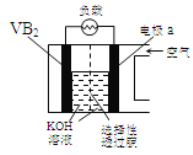
该电池工作时反应为:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列说法正确的是
A.VB2极发生的电极反应为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.电极a为电池负极
C.电流由VB2极经负载流向电极a
D.图中选择性透过膜允许阳离子选择性透过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2 > Fe3+ >SO2,某化学研究性学习小组用图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
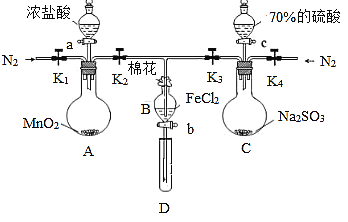
Ⅰ.打开弹簧夹K1—K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
回答下列问题:
(1)过程Ⅰ的目的是________。
(2)棉花中浸润的溶液为________,作用是_____________。
(3)导致步骤Ⅲ中溶液变黄的离子反应是____,用_____,(写试剂化学式)检验氧化产物,现象是____。
(4)能说明氧化性Fe3+>SO2的离子方程式是________。
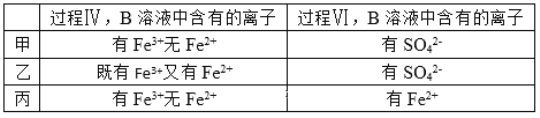
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2> Fe3+>SO2的是__(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程将太阳能转化成为化学能
B.该过程中,涉及极性键和非极性健的断裂与生成
C.氧化剂与还原剂的物质的量之比为3∶1
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。因此采取改善能源结构、机动车限号等措施来减少PM2.5、SO2、NOx等污染。请回答下列问题:
Ⅰ. 臭氧是理想的烟气脱硝剂,其脱硝的反应之一为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | 1molO3和2molNO2 | 1molO3和2molNO2 |
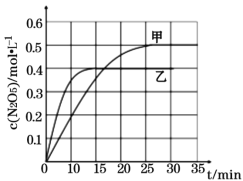
①0~15min内乙容器中反应的平均速率:v(NO2) =____(计算结果保留两位小数)。
②该反应的正反应为____(填“吸热”或“放热”)反应。
③T1时平衡后,向恒容容器中再充入1molO3和2molNO2,再次平衡后,NO2的百分含量将____(填“增大”“减小”或“不变”)。
④反应体系在温度为T1时的平衡常数为____。
⑤在恒温恒容条件下,下列条件不能证明该反应已经达到平衡的是____。
a.容器内混合气体压强不再改变
b.消耗2n molNO2的同时,消耗了n molO3
c.混合气体的平均相对分子质量不再改变
d.混合气体密度不再改变
II. 某化学小组查阅资料后得知:2NO(g)+O2(g) ![]() 2NO2(g) 的反应历程分两步:
2NO2(g) 的反应历程分两步:
①2NO(g)=N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)=2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2)
请回答下列问题:
(1)已知决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
2NO2(g)反应速率的是反应②,则反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(2)一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L四氯化碳分子数为NA
B. 常温下,16gO2和O3组成的混合气体中所含有的原子数为NA
C. 常温下,1mol/L的AlCl3溶液中含有的Cl-离子数为3NA
D. 18gNH4+离子中所含的电子总数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是
A.用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
B.向CH3CH2Br中滴入AgNO3溶液以检验溴元素
C.用溴的四氯化碳溶液吸收SO2气体
D.![]() 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com