
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4===H++HSO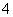 ,HSO
,HSO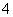 H++SO
H++SO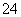 。
。
请回答下列有关问题:
(1)Na2SO4溶液 呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
_____________________________________________________________。
(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO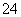 )+c(HSO
)+c(HSO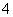 )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO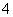 )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO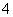 )+2c(SO
)+2c(SO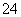 )
)
D.c(Na+)=2c(SO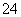 )+2c(HSO
)+2c(HSO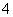 )
)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO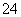 )=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO
)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO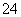 )________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
________________________________________________________________________
________________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO )=________ mol·L-1。
)=________ mol·L-1。
解析:(1)由题中信息可得,硫酸钠是弱酸强碱盐,易水解生成硫酸氢钠:Na2SO4+H2ONaHSO4+NaOH,所以硫酸钠溶液呈弱碱性。(2)硫酸氢根离子部分电离,是弱酸根离子,硫酸与氯化钡反应的离子方程式为Ba2++HSO ===BaSO4↓+H+。(3)A项,由题意知,硫酸钠溶液中存在的阳离子:Na+、H+,阴离子:SO
===BaSO4↓+H+。(3)A项,由题意知,硫酸钠溶液中存在的阳离子:Na+、H+,阴离子:SO 、OH-、HSO
、OH-、HSO ,溶液中不存在H2SO4,A项错误;B项,物料守恒式为c(Na+)=2c(SO
,溶液中不存在H2SO4,A项错误;B项,物料守恒式为c(Na+)=2c(SO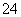 )+2c(HSO
)+2c(HSO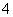 ),电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HSO
),电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HSO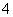 )+2c(SO
)+2c(SO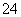 ),两式相减,得质子守恒式:c(OH-)=c(H+)+c(HSO
),两式相减,得质子守恒式:c(OH-)=c(H+)+c(HSO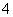 ),B、C、D项正确。(4)硫酸氢钠溶液中存在:HSO
),B、C、D项正确。(4)硫酸氢钠溶液中存在:HSO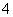 H++SO
H++SO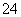 ;硫酸溶液中存在:H2SO4===H++HSO
;硫酸溶液中存在:H2SO4===H++HSO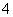 ,HSO
,HSO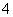 H++SO
H++SO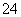 ,硫酸第一步电离出来的H+对第二步电离有抑制作用,使平衡向左移动,故同浓度的硫酸溶液中c(SO
,硫酸第一步电离出来的H+对第二步电离有抑制作用,使平衡向左移动,故同浓度的硫酸溶液中c(SO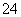 )小于硫酸氢钠溶液中的c(SO
)小于硫酸氢钠溶液中的c(SO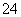 )。
)。
(5)0.10 mol·L-1H2SO4溶液中c(H+)=0.11 mol·L-1,由于硫酸在水中第一步完全电离,第二步部分电离,所以c(SO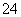 )=0.01 mol·L-1。
)=0.01 mol·L-1。
答案:(1)弱碱性
SO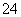 +H2OHSO
+H2OHSO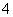 +OH-
+OH-
(2)Ba2++HSO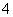 ===BaSO4↓+H+
===BaSO4↓+H+
(3)BCD
(4)< H2SO4===HSO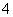 +H+,电离出的H+抑制HSO
+H+,电离出的H+抑制HSO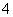 的电离
的电离
(5)0.01


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.按分散剂种类可将分散系分为溶液、胶体和浊液
B. 漂白粉、钢、氯水、Fe(OH)3胶体均为混合物
C. CO2、SO3、NO2和水反应均能生成相应的酸,都属于酸性氧化物
D. KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)C(g)+D(g),5 mi n后达到平衡,已知各物质的平衡浓度
n后达到平衡,已知各物质的平衡浓度 的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A的转化率没有发生变化,则B的转化率为( )
A.60% B.40%
C.24% D.4%
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.25℃时,三种酸的电离常数为:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:________(填编号)
(2)常温下0.1 mol/L的CH3COOH电离度约为1%,其pH=________,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
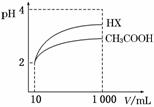
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000 mL,稀释过程pH变化如图;则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”)。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH 3COO-)-c(Na+)=________(填准确数值)。
3COO-)-c(Na+)=________(填准确数值)。
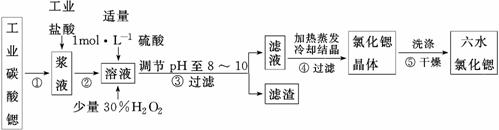
Ⅱ.锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图。
请回答:
(5)步骤③中调节溶液pH至8~10,宜选用的试剂为________。
A.稀硫酸 B.氢氧化锶粉末
C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是________(填化学式)。
(6)若滤液中Ba2+ 浓度为1×10-5mol·L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为________。
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1 × 10-10 | 3.2 × 10-4 | 2.6× 10-39 | 4.87× 10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH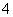 )
)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH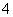 )>c(SO
)>c(SO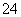 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是
( )
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
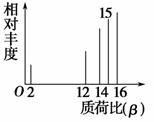 设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
( )
A.甲醇(CH3OH) B.甲烷
C.丙烷 D.乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的说法中,正确的是( )
A.胶体与溶液有明显不同的外观特征,胶体呈胶状
B.胶体不稳定,静止后容易产生沉淀
C.将Fe(OH)3胶体进行过滤,所得到的滤液与原来胶体的组成是不同的
D.豆浆是胶体,因为豆浆中的分散质微粒直径在1~100 nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
B.小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C. C、Si、S都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应
D.碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com