
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋 | |
| C. | 二氧化硅可用于制备太阳能电池板 | |
| D. | 装饰材料释放的甲醛会造成污染 |
分析 A.NH4NO3在重力撞击下发生分解反应;
B.硅胶具有吸水性,可作干燥剂;
C.硅单质用于制备太阳能电池板;
D.甲醛有毒性,会污染空气.
解答 解:A.NH4NO3在重力撞击下发生分解反应,反应瞬间生成大量气体,所以NH4NO3在重力撞击下可能发生爆炸,故A正确;
B.硅胶具有吸水性,可作干燥剂,所以在食品袋中放入盛有硅胶的透气小袋,可吸收水蒸气防止食物受潮,故B正确;
C.硅单质是重要的半导体材料,用于制备太阳能电池板,二氧化硅可用于制作光导纤维,故C错误;
D.装饰材料会释放甲醛,甲醛有毒性,会污染空气,故D正确.
故选C.
点评 本题考查了铵盐、硅胶、硅单质和二氧化硅、甲醛等的性质和应用,题目难度不大,注意把握常见物质的性质及应用.


科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1•s-1 | B. | 0.4 mol•L-1•s-1 | C. | 0.6 mol•L-1•s-1 | D. | 0.8 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若硫酸足量会有氢气生成 | |
| B. | 离子方程式为Cu2O+2H+=Cu2++Cu+H2O | |
| C. | 会得到蓝色溶液 | |
| D. | 氧化剂、还原剂均是Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L水所含的分子数目为0.1 NA | |
| B. | 9g水中含有的电子数目为0.5NA | |
| C. | 0.3 mol/L的MgCl2溶液中含Mg2+数目为0.3 NA | |
| D. | 常常压下,28gN2和CO混合气体中所含有的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应一定是熵增反应 | |
| B. | 合成氨的反应达到平衡后,给体系加压(压缩),活化分子百分数增加,所以反应速率加快 | |
| C. | 活化分子之间的碰撞都是有效碰撞,都能引发化学反应 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体.而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:
(1)A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体.而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
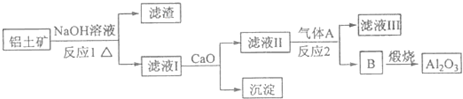

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com