
| A、c(S2-)>c(HS-)>c(OH-)>c(H+) |
| B、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| C、c(Na+)+c(H+)>c(HS-)+c(S2-)+c(OH-) |
| D、3c(S2-)+3c(HS-)+3c(H2S)=2c(Na+) |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,冷却后滴加淀粉溶液 | 变蓝 | 淀粉未发生水解 |
| B | 向同温同浓度Na2CO3和Na2SiO3水溶液的滴加酚酞试剂 | 碳酸钠溶液 红色较深 | 碳的非金属性强于硅 |
| C | 将某气体通入淀粉碘化钾溶液中 | 溶液变蓝色 | 该气体一定是Cl2 |
| D | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
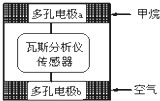 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1 mol O2-通过时,电子转移4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z |
| A、三种元素中,元素Z的最高价氧化物对应水化物的酸性最强 |
| B、单核阴离子半径的大小顺序为:r(Z)>r(Y)>r(X) |
| C、元素X和元素Z的氢化物中均只存在极性共价键 |
| D、元素X和元素Z的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量铁在氯气中反应,l mol铁失去的电子数为2 NA |
| B、标准状况下22.4 L H2中含中子数为2 NA |
| C、1 L Imol/L的盐酸溶液中,所含氯化氢分子数为NA |
| D、常温下46 g NO2和N2O4混合气体中含有原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com