
【题目】三氯氧磷(化学式:POCl3)无色透明的带刺激性臭味的液体,熔点1.25℃、沸点1.5℃,在潮湿空气中剧烈发烟,易与水反应。常用作半导体掺杂剂及光导纤维原料。工业上,“氯化水解法”生产三氯氧磷的方法一般是将三氯化磷加入反应釜中,通入氯气,同时滴加水,控制氯水比在3.94左右,并控制氯气和水的通入速率,其流程如下:

(1)在反应釜中将原料加热至105~109℃,“氯化水解法”生产三氯氧磷的化学方程式为___________。
(2)冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和_________(填化学式)等杂质,进一步精制的方法是____________。
(3)已知H3PO3是—种易溶于水的二元弱酸。
①若将20 mL溶液与60 mL NaOH溶液等浓度混合并充分反应,化学方程式为______________。
②往废水中加入适量漂白粉并调节pH呈酸性,可将磷元素转化为磷酸钙沉淀回收,写出将H3PO3转化为磷酸钙的离子方程式:_____________________。
③经上述方法处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+) =________mol·L-1。
(已知 Ksp[Ca3(PO4)2] = 2×10-29)
(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是_______________________。(写出两点)
【答案】 PCl3+2H2O+Cl2![]() POCl3+2HCl H3PO4 蒸馏(或分馏) H3PO3+2NaOH═Na2HPO3+2H2O 2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O 5×10-6 原子利用率高、无副产物,对环境污染小等合理答案均可
POCl3+2HCl H3PO4 蒸馏(或分馏) H3PO3+2NaOH═Na2HPO3+2H2O 2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O 5×10-6 原子利用率高、无副产物,对环境污染小等合理答案均可
【解析】⑴“氯化水解法”生产三氯氧磷的反应物有PCl3、H2O、Cl2,生成物有POCl3,据原子守恒应该还有HCl生成,然后通过观察法将其配平,其化学方程式为:PCl3+2H2O+Cl2![]() POCl3+2HCl;⑵冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和H3PO4等杂质,利用各成分的沸点不同,进一步精制的方法是蒸馏或分馏;(3)①H3PO3与NaOH反应生成Na2HPO3,其化学方程式为:H3PO3+2NaOH═Na2HPO3+2H2O;②漂白粉在酸性条件下将H3PO3转化为磷酸钙的离子方程式为:2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O;③已知 Ksp[Ca3(PO4)2] = 2×10-29,处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+)=
POCl3+2HCl;⑵冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和H3PO4等杂质,利用各成分的沸点不同,进一步精制的方法是蒸馏或分馏;(3)①H3PO3与NaOH反应生成Na2HPO3,其化学方程式为:H3PO3+2NaOH═Na2HPO3+2H2O;②漂白粉在酸性条件下将H3PO3转化为磷酸钙的离子方程式为:2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O;③已知 Ksp[Ca3(PO4)2] = 2×10-29,处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+)=![]() mol·L-1=5×10-6mol·L-1;(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是原子利用率高、无副产物,对环境污染小等。
mol·L-1=5×10-6mol·L-1;(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是原子利用率高、无副产物,对环境污染小等。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实验的说法中,不正确的是()

A. 所充氯气应用向上排空气法收集
B. 反应中,烧瓶内产生大量白色烟雾
C. 玻璃导管只起到定位加入钠和水的作用
D. 烧瓶中Cl2,可能参与四个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是
①SiO2 ②H2SiO3 ③Al(OH)3 ④Fe(OH)3 ⑤FeCl2
A. ①③ B. ②③ C. ①④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇和乙酸都是常用调味品的主要成分
B. 乙醇和乙酸的沸点和熔点都比C2H6和C2H4的沸点和熔点高
C. 乙酸和乙醇之间能发生酯化反应
D. 乙醇 和乙酸都能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子轨道表示式为________________。乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。1mol (C2H5O)3P=O分子中含有的σ键与π键的数目比为_________。
已知固态NH3、H2O、HF的氢键键能和结构如下:


①在冰晶体中每个水分子被距离最近的_____个水分子包围形成_____________构型。
②解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似(如图所示),其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳原子的半径为a nm,硅原子的半径为b nm,则碳化硅的密度为__________g·cm-3 (只需列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是
A.该溶液可能pH=5B.该溶液的pH一定是9
C.该溶液的pH可能是7D.不会有这样的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水(______)
(2)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(_______)
(3)按照下图操作,配制一定浓度的NaCl溶液(_____)

(4)按照下图操作,配制0.10 mol·L-1 NaOH溶液(______)
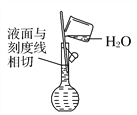
(5)配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高(_______)
(6) 配制溶液(_______)
配制溶液(_______)
(7)因为Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液(_____)
(8)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流(_______)
(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(________)
(10)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶(_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于_____区的元素,其基态原子的价电子排布图为_____。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为_____(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有_____种,任意画出一种:_____。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为_____ (用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为_____;A的中心原子的轨道杂化类型为_____;与A互为等电子体的一种分子为_____ (填化学式)。
(5)向e的硫酸盐中加入氨水首先形成蓝色沉淀,继续滴加氨水沉淀溶解,得到深蓝色的透明溶液,试用离子方程式解释产生这一现象的原因:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com