
|
在下列溶液中,c(Cl-)与150 mL 1 mol·L-1 AlCl3溶液中的c(Cl-)相等的是 | |
| [ ] | |
A. |
150 mL 3 mol·L-1的CaCl2溶液 |
B. |
75 mL 1.5 mol·L-1的MgCl2溶液 |
C. |
50 mL l mol·L-1的FeCl2溶液 |
D. |
225 mL 2 mol·L-1的NH4Cl溶液 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:阅读理解
| c(H+)?c(CH3COO-) | c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(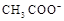 )+c(
)+c( )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省苏北四市高三第二次调研考试化学试卷 题型:选择题
下列溶液中各微粒的浓度关系一定正确的是
A.某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,则溶液中:
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.在Na2CO3和NaHCO3的混合溶液中:
c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.将0.1 mol CuSO4·(NH4)2SO4·6H2O溶于水配成的1 L溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
D.等体积、等浓度的NaX溶液和弱酸HX溶液的混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:0113 月考题 题型:单选题
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com